
【題目】鹽酸阿比多爾是一種鹽酸鹽,其主要作用是通過抑制流感病毒脂膜與宿主細胞的融合而阻斷病毒的復制,結構如圖。回答下列問題:
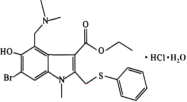
(1)鹽酸阿比多爾中所含N、O、S三種元素第一電離能由大到小的順序為___。O原子核外有___種不同運動狀態的電子,基態S原子的價電子排布圖不是![]() ,是因為該排布方式違背了___。
,是因為該排布方式違背了___。
(2)該結構中N原子的雜化方式是___。已知在氨分子中,H—N—H鍵角為107.3°,但是在[Zn(NH3)6]2+離子中H—N—H鍵角變為109.5°,分析原因為___。
(3)鹽酸阿比多爾中不含有的化學鍵類型為___(填選項字母)。
A.離子鍵 B.配位鍵 C.金屬鍵 D.σ鍵 E.π鍵 F.極性鍵 G.非極性鍵
(4)以氮化鎵(GaN)為代表的第三代半導體材料目前已成為全球半導體研究的前沿和熱點。GaN晶胞如圖1所示,圖2為晶胞沿y軸的投影1∶1平面圖。
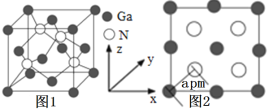
①氮化硼與氮化鎵的結構類似,氮化硼熔點3000℃,氮化鎵熔點1700℃,分析它們熔點不同的原因____。
②晶胞中與一個Ga原子距離最近且相等的N原子有____個。
③設阿伏加德羅常數的值為NA,則該晶胞的密度是___g·cm3(列出計算表達式)。
【答案】N>O>S 8 洪特規則 sp3、sp2 氨分子與Zn2+形成配合物后,孤對電子與Zn2+成鍵,原孤對電子與成鍵電子對之間的排斥作用變為成鍵電子對之間的排斥作用,排斥作用減弱,所以H—N—H鍵角變大 C 氮化硼和氮化鎵都是共價晶體,B—N鍵長比Ga—N鍵長短,鍵能大,熔點高 4 ![]()
【解析】
(1)同周期元素從左至右第一電離能呈逐漸增大的趨勢,同主族元素從上到下第一電離能呈逐漸減小的趨勢,N原子最外層電子排布為半充滿狀態,處于穩定狀態,第一電離能比同周期相鄰元素大,則N、O、S三種元素第一電離能由大到小的順序為N>O>S;O原子核外有8個電子,每個電子的運動狀態都不同,則不同運動狀態的電子有8種;洪特規則規定電子分布到能量簡并的原子軌道時,優先以自旋相同的方式分別占據不同的軌道,因為這種排布方式原子的總能量最低,則基態S原子的價電子排布圖![]() 違反了洪特規則;
違反了洪特規則;
(2)鹽酸阿比多爾分子結構中含有2個N原子,分別如圖標注所示: ,1號氮原子與三個碳原子形成碳氮單鍵,類似于氨分子的空間結構,該氮原子為sp3雜化,2號氮原子與碳碳雙鍵直接相連,與碳碳雙鍵形成平面結構,該氮原子的空間構型為平面三角形,為sp2雜化;氨分子與Zn2+結合變為[Zn(NH3)6]2+時,孤電子對變為成鍵電子對,原孤對電子與成鍵電子對之間的排斥作用變為成鍵電子對之間的排斥作用,排斥作用減弱,所以H—N—H鍵角變大,因此氨分子中,H—N—H鍵角為107.3°,但是在[Zn(NH3)6]2+離子中H—N—H鍵角變為109.5°;
,1號氮原子與三個碳原子形成碳氮單鍵,類似于氨分子的空間結構,該氮原子為sp3雜化,2號氮原子與碳碳雙鍵直接相連,與碳碳雙鍵形成平面結構,該氮原子的空間構型為平面三角形,為sp2雜化;氨分子與Zn2+結合變為[Zn(NH3)6]2+時,孤電子對變為成鍵電子對,原孤對電子與成鍵電子對之間的排斥作用變為成鍵電子對之間的排斥作用,排斥作用減弱,所以H—N—H鍵角變大,因此氨分子中,H—N—H鍵角為107.3°,但是在[Zn(NH3)6]2+離子中H—N—H鍵角變為109.5°;
(3)鹽酸阿比多爾是一種鹽酸鹽,屬于離子化合物,含有離子鍵;類比銨鹽的形成,氨基中氮原子與HCl中的氫離子形成配位鍵;根據結構圖所示,結構中含有多條不同的單鍵,單鍵都為σ鍵,分子結構中含有苯環和碳氧雙鍵,苯環中含有離域大π鍵,碳氧雙鍵中一個σ鍵和一個π鍵;氫氧單鍵為不同非金屬元素形成的共價鍵,為極性共價鍵,碳碳鍵由同種元素形成的共價鍵,為非極性共價鍵,金屬鍵為金屬晶體中特有的鍵,該鹽中不含金屬鍵,答案選C;
(4)①氮化硼和氮化鎵都是共價晶體,B—N鍵長比Ga—N鍵長短,鍵能大,熔點高;
②以該晶胞中面心上的Ga為中心,與該Ga原子距離最近且相等的N原子有2個,該晶胞上方無隙并置一個相同的晶胞,還有兩個與該Ga原子距離最近且相等的N原子,則共有4個;
③根據圖1所示,Ga位于晶胞的頂點和面心,Ga原子的數目為![]() ×8+6×
×8+6×![]() =4個,N位于晶胞的體內,N原子的個數為4個,則一個晶胞中含有4個氮化鎵(GaN),晶胞的質量為
=4個,N位于晶胞的體內,N原子的個數為4個,則一個晶胞中含有4個氮化鎵(GaN),晶胞的質量為![]() ,根據圖2所示,晶胞的面對角線長度為4apm=4a×10-10cm,則晶胞的邊長為,則晶胞的體積為(2
,根據圖2所示,晶胞的面對角線長度為4apm=4a×10-10cm,則晶胞的邊長為,則晶胞的體積為(2![]() a×10-10)3 cm3,根據晶胞密度計算公式ρ=
a×10-10)3 cm3,根據晶胞密度計算公式ρ= =
=![]() 。
。


科目:高中化學 來源: 題型:
【題目】取1 mL 0.1 mol·L-1 AgNO3溶液進行如下實驗(實驗中所用試劑濃度均為0.1 mol·L-1):

下列說法不正確的是
A. 實驗①白色沉淀是難溶的AgCl B. 由實驗②說明AgI比AgCl更難溶
C. 若按①③順序實驗,看不到黑色沉淀 D. 若按②①順序實驗,看不到白色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】法匹拉韋(Favipiravir)是一種RNA聚合酶抑制劑,被用于治療新型和復發型流感,主要通過阻斷病毒核酸復制的方法抑制病毒增殖,其結構如圖。下列關于法匹拉韋的說法錯誤的是( )
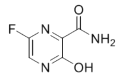
A.分子式為C5H4FN3O2
B.所有原子可能在同一平面上
C.所有碳原子的雜化方式都是sp2雜化
D.一定條件下能與氫氧化鈉溶液、鹽酸、氫氣等發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用KMnO4酸性溶液處理硫化亞銅(Cu2S)和二硫化亞鐵(FeS2)的混合物時,發生的反應Ⅰ:![]() +Cu2S+H+→Cu2++
+Cu2S+H+→Cu2++![]() +Mn2++H2O(未配平)和反應Ⅱ:
+Mn2++H2O(未配平)和反應Ⅱ:![]() +FeS2+H+→Fe3++
+FeS2+H+→Fe3++![]() +Mn2++H2O(未配平)。下列說法正確的是( )
+Mn2++H2O(未配平)。下列說法正確的是( )
A.反應Ⅰ中Cu2S既是氧化劑又是還原劑
B.反應Ⅰ中每生成1mol![]() ,轉移電子的物質的量為10mol
,轉移電子的物質的量為10mol
C.反應Ⅱ中氧化劑與還原劑的物質的量之比為1:3
D.若反應Ⅰ和反應Ⅱ中消耗的KMnO4的物質的量相同,則反應Ⅰ和反應Ⅱ中消耗的還原劑的物質的量之比為3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,某濃度的H2A溶液中滴加NaOH溶液,若定義pc=-lgc,則測得pc(H2A)、pc(HA-)、pc(A2-)變化如圖所示。下列說法錯誤的是( )
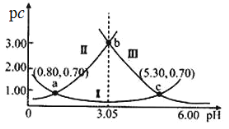
A.pH=3時溶液中c(A2-)>c(H2A)>c(HA-)
B.常溫下,H2A的Ka1=10-0.80,Ka2=10-5.30
C.NaHA溶液中c(H+)>c(OH-)
D.從a點到c點,![]() 先增大后減小
先增大后減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于一定條件下的化學平衡H2(g)+I2(g)![]() 2HI(g) ΔH<0,下列說法正確的是( )
2HI(g) ΔH<0,下列說法正確的是( )
A.恒溫恒容,充入H2,v(正)增大,平衡右移
B.恒溫恒容,充入He,v(正)增大,平衡右移
C.加壓,v(正),v(逆)不變,平衡不移動
D.升溫,v(正)減小,v(逆)增大,平衡左移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國化學家侯德榜根據NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性質,運用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反應原理制備純堿.下面是在實驗室進行模擬實驗的生產流程示意圖:氣體A的飽和溶液![]() A和食鹽的飽和溶液
A和食鹽的飽和溶液![]() 懸濁液
懸濁液![]() 晶體
晶體![]() 純堿,則下列敘述錯誤的是( )
純堿,則下列敘述錯誤的是( )
A.A氣體是CO2,B氣體是NH3
B.第Ⅲ步得到的晶體是發酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃儀器是燒杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要過程有溶解、蒸發、結晶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用已知濃度的鹽酸滴定未知濃度的NaOH溶液時,下列操作不正確的是( )
A.酸式滴定管用蒸餾水洗凈后,直接加入已知濃度的鹽酸
B.錐形瓶用蒸餾水洗凈后,直接加入一定體積的未知濃度的NaOH溶液
C.滴定時,眼睛觀察錐形瓶中溶液顏色的變化
D.讀數時,視線與滴定管內液體的凹液面最低處保持水平
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2S存在于多種燃氣中,脫除燃氣中H2S的方法很多。
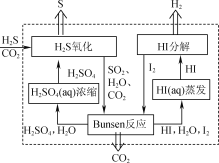
(1) 2019年3月《science direct》介紹的化學鏈技術脫除H2S的原理如圖所示。
①“H2S氧化”反應中氧化劑與還原劑的物質的量之比為________。
②“HI分解”時,每1 mol HI分解生成碘蒸氣和氫氣時,吸收13 kJ的熱量,寫出該反應的熱化學方程式:________。
③“Bunsen反應”的離子方程式為________。
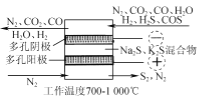
(2) 電化學干法氧化法脫除H2S的原理如圖所示。陽極發生的電極反應為________;陰極上COS發生的電極反應為________。
(3) 用Fe2(SO4)3吸收液脫除H2S法包含的反應如下:
(Ⅰ) H2S(g)![]() H2S(aq)
H2S(aq)
(Ⅱ) H2S(aq) ![]() H++HS-
H++HS-
(Ⅲ) HS-+2Fe3+=S↓+2Fe2++H+
一定條件下測得脫硫率與Fe3+濃度的關系如圖所示。

①吸收液經過濾出S后,濾液需進行再生,較經濟的再生方法是________。
②圖中當Fe3+的濃度大于10 g·L-1時,濃度越大,脫硫率越低,這是由于________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com