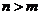A.該物質的分子式為C9H16NO3 B.1mol該物質與NaOH溶液反應,可以消耗2mol NaOH C.該物質在強堿的醇溶液中可以發生消去反應 D.該物質與濃溴水既能發生取代反應,又能發生加成反應
試題詳情
7.下列對有關化學反應過程或實驗現象的解釋中,正確的是 A.Cl2的水溶液可以導電,說明Cl2是電解質 B.在高溫條件下,C能置換出SiO2中的Si,說明C的氧化性強于Si C.向淀粉碘化鉀的溶液中加入氯水,溶液變為藍色,說明Cl2的氧化性強于I2 D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液,溶液褪色,說明BaCl2溶液有酸性 試題詳情
8. 某些鹽在溶液中結晶時,析出的晶體是結晶水合物。下表記錄了t℃的4份相同的硫酸銅 溶液中加入的無水硫酸銅的質量以及析出的硫酸銅晶體(CuSO4?5H2O)的質量(溫度維持 不變)的實驗數據: 硫酸銅溶液 ① ② ③ ④ 加入的無水硫酸銅(g) 試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
試題詳情
當加入5.60
g 無水硫酸銅時,析出硫酸銅晶體的質量為 試題詳情
A. 3.88 g B.5.32 C.5.68 g D.6.82 g 試題詳情
二.選擇題(本題包括8小題,每小題4分,共32分,每題有一個或兩個選項符合題意。只有一個選項的,多選不給分;有兩個選項的,選對一個給2分,選錯一個該題不給分)
試題詳情
試題詳情
   缺鈣 會得甲狀腺腫大
食用碘鹽 補充鈣元素 缺鈣 會得甲狀腺腫大
食用碘鹽 補充鈣元素
缺碘
會得佝僂病
服補血口服液 補充碘元素 試題詳情
  C. 碘 抗癌之星 D.少吃油條 加醋后可長時間燉煮 C. 碘 抗癌之星 D.少吃油條 加醋后可長時間燉煮
試題詳情
試題詳情
 氟 齲齒克星 使用鋁鍋 因油條中含有明礬 氟 齲齒克星 使用鋁鍋 因油條中含有明礬
試題詳情
10.接觸法制硫酸通常在400~500℃、常壓和催化劑的作用下,用SO2與過量的O2反應生成SO3。 2SO2(g)+O2(g) 2SO3(g)
;△H < O 在上述條件下,SO2的轉化率約為90%。但是部分發達國家采用高壓條件制取SO3,采取加壓措施的目的是 2SO3(g)
;△H < O 在上述條件下,SO2的轉化率約為90%。但是部分發達國家采用高壓條件制取SO3,采取加壓措施的目的是 A.發達國家電能過量,以此消耗大量能源 B.高壓將使平衡向正反應方向移動,有利于進一步提高SO2的轉化率 C.加壓可使SO2全部轉化為SO3,消除SO2對空氣的污染 D.高壓有利于加快反應速率,可以提高生產效率 試題詳情
11.下列反應的離子方程式錯誤的是 A.等物質的量的Ba(OH)2與NH4HSO4在稀溶液中反應: Ba2++2OH―+2H++SO42―=BaSO4↓+2H2O B.氫氧化鐵與足量的氫溴酸溶液反應:Fe(OH)3+3H+=Fe3++3H2O C.足量的CO2通入飽和碳酸鈉溶液中:CO2+2Na++CO32―+H2O=2NaHCO3↓ D.向碳酸氫鈉溶液中滴入過量澄清石灰水:Ca2++2OH―+2HCO3―=CaCO3↓+CO32―+2H2O 試題詳情
12.某無色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干種組成。取適量該溶液進行如下實驗:① 加入過量鹽酸,有氣體生成;②
在①所得的溶液中再加入過量碳酸氫銨溶液,有氣體生成,同時析出白色沉淀甲;③ 在②所得溶液中加入過量Ba(OH)2溶液,也有氣體生成,并有白色沉淀乙析出。原溶液中一定存在的離子是 A.Al3+、Fe3+、SO42-
B.Na+、AlO2-、CO32- C.Na+、AlO2-、SO42-、CO32- D.Na+、Ba2+、AlO2- 試題詳情
13.已知:SO32一+I2+H2O=SO42一+2H++2I一,某溶液中可能含有I一、 NH4+、Cu2+、SO32一,向該無色溶液中加人少量溴水,溶液仍呈無色,則下列關于潑溶液組成的判斷正確的是 A.肯定不含I一
B.肯定不含Cu2+ C.可能含有SO32一
D.可能含有I一 試題詳情
14.某化學興趣小組用回收的鎂鋁合金制取氫氣。現有l0.8 g鎂鋁合金,下列說法正確的是 試題詳情
A.常溫下與足量18mol/LH2SO4溶液反應,最多可放出0.6 mol H2 試題詳情
B.常溫下與足量2mol/LHNO3溶液反應,最少可放出0.45 mol H2 試題詳情
C.常溫下與足量2 mol/L H2SO4溶液反應,放出H2的物質的量在0.45 ~0.6 mol之間 試題詳情
D.常溫下與足量2mol/LNaOH溶液反應,放出H2的物質的量在0.45 ~0.6 mol之間 試題詳情
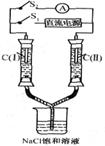 15.如右圖所示裝置,兩玻璃管中盛滿滴有酚酞溶液的NaCl飽和溶液, C(Ⅰ)、c(Ⅱ)為多孔石墨電極。斷開S2接通S1后,c(I)附近溶液變紅,兩玻璃管中有氣體生成。一段時間后(兩玻璃管中液面未脫離電極),斷開S1,接通S2,電流表的指針發生偏轉.說明此時該裝置形成了原電池。關于該原電池的敘述正確的是 15.如右圖所示裝置,兩玻璃管中盛滿滴有酚酞溶液的NaCl飽和溶液, C(Ⅰ)、c(Ⅱ)為多孔石墨電極。斷開S2接通S1后,c(I)附近溶液變紅,兩玻璃管中有氣體生成。一段時間后(兩玻璃管中液面未脫離電極),斷開S1,接通S2,電流表的指針發生偏轉.說明此時該裝置形成了原電池。關于該原電池的敘述正確的是
A.C(I)的電極名稱是負極
B.C(Ⅱ)的電極名稱是陽極 C.C(I)的電極反應式是2H++2e一=H2↑ D.C(Ⅱ)的電極反應式是Cl2 +2e一=2Cl一 試題詳情
16.常溫下,0.1 mol?L-1某一元酸(HA)溶液中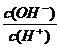 =1×10-8,下列敘述正確的是 =1×10-8,下列敘述正確的是 A.該溶液中由水電離出的c(H+)=1×10-11 mol?L-1 試題詳情
B.濃度均為0.1mol/L的HA和NaA溶液等體積混合后,若溶液呈酸性, 則c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) 試題詳情
C.0.1 mol?L-1HA溶液與0.05
mol?L-1 NaOH溶液等體積混合后所得溶液中 c(A-) + c(HA) = c(Na+) 試題詳情
D.0.1 mol?L-1HA溶液與0.05 mol?L-1 NaOH溶液等體積混合后所得溶液中 2c(H+)+
c(HA) = c(A-) + 2c(OH-) 第Ⅱ卷(非選擇題 共86分) 試題詳情
三.(本題包括2小題,共22分) 17.(10分)Na2O2與水的反應實際是Na2O2 +
2H2O === 2NaOH + H2O2,反應放熱,反應放出的熱量使部分H2O2受熱分解:2H2O2===2H2O
+O2↑。為了測定某過氧化鈉固體的純度,今做如下實驗:①稱取過氧化鈉固體2.00g;②把這些過氧化鈉固體放入氣密性良好的氣體發生裝置中;③向過氧化鈉中滴加水,用某一量筒排水集氣,量筒內液面在110mL處恰好與水槽內液面相平;④將燒瓶中的液體轉移到250mL的容量瓶中,然后加入蒸餾水,定容,使液面恰好與刻度相切;⑤用移液管移取25.00mL容量瓶中的液體,放入錐形瓶中,用過量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至終點時用去了24.20 mLKMnO4溶液(此時錳全部以Mn2+存在) (1)有500ml、250ml、150ml的量筒備用,應選用量程為
的量筒,理由是
; (2)有酸式和堿式兩種滴定管備用,該實驗應選用 ,理由是
; 試題詳情
 (3)在步驟③測量氣體體積時,必須待試管和量筒內的氣體都 (3)在步驟③測量氣體體積時,必須待試管和量筒內的氣體都
冷卻到室溫時進行,應選用下圖裝置中
,理由是
;此時量筒內的液面高于水槽中液面,立即讀數會使Na2O2的純度 (填“偏高”“偏低”或“不變”);應進行的操作是 ; (4)在步驟⑤中滴定達到終點時,溶液的顏色變化是
; (5)該過氧化鈉的純度為
(實驗中得到的氣體體積均看作為標準狀況下)。 試題詳情
18.(12分)某化學興趣小組參考工業制硝酸的化學原理,在實驗室用下列各裝置進行組合來制備硝酸并驗證硝酸的性質(所給裝置必須用到并且只能用一次,各裝置中的試劑均足量。已知常溫下CaCl2能吸收氨氣)。 試題詳情
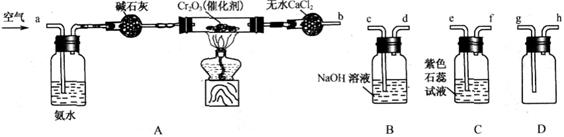 (1)裝置的連接順序為(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。 (1)裝置的連接順序為(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)寫出氨氣催化氧化的化學方程式______________________。 (3)進行實驗時,裝置A中堿石灰的作用是_________;D中的現象是__________________。 (4)能證明有硝酸生成的現象是__________________________________________。 (5)實驗開始時,下列操作順序最合理的是______________。 a.先加熱A裝置中的催化劑.再由導管a通入空氣 b.先由導管a通入空氣,再加熱A裝置中的催化劑 c.在由導管a通入空氣的同時,加熱A裝置中的催化劑 試題詳情
四.(本題包括2小題,共18分) 19.(8分)(1)若AgC1在水中、0.01 mol?L-1 CaCl2溶液中、0.01 mol?L-1 NaCl溶液中及0.05 mol?L-1AgNO3溶液中的溶解度分別為S1、S2、S3、S4,則S1、S2、S3、S4由大到小的順序為
。 (2)下列曲線分別表示元素的某種性質與核電荷的關系(Z為核電荷數,Y為元素的有關 性質)。把與下面元素有關的性質相符的曲線標號填入相應的空格中: 試題詳情
①ⅡA族元素的價電子數
;②第3周期元素的最高化合價
; (3)元素X、Y、Z、M、N均為短周期主族元素,且原子序數依次增大。已知Y原子最外層電子數與核外電子總數之比為3:4;M元素原子的最外層電子數與電子層數之比為4:3;N-、Z+、X+離子的半徑逐漸減小;化合物XN常溫下為氣體。據此回答: ①N的最高價氧化物的水化物的化學式為
。 ②化合物A、B均為由上述五種元素中的任意三種元素組成的強電解質,且兩種物質水溶液的酸堿性相同,組成元素的原子數目之比均為1:1:1,A溶液中水的電離程度比B溶液中水的電離程度小。則化合物A中的化學鍵類型為
,B的化學式為 。 ③工業上制取單質M的化學方程式為
。 試題詳情
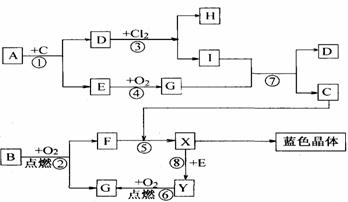 20.(10分)下圖是中學化學中一些常見的物質之間發生的一系列轉化的框圖(反應所需和所產生的水及某些反應條件已略),其中A、B、F、Y為黑色的固體,E、G在常溫常壓下是氣體。 20.(10分)下圖是中學化學中一些常見的物質之間發生的一系列轉化的框圖(反應所需和所產生的水及某些反應條件已略),其中A、B、F、Y為黑色的固體,E、G在常溫常壓下是氣體。
(1)寫出下列物質的化學式:D____________,E____________。 (2)寫出G通入I溶液發生反應⑦的離子方程式___________________________。 (3)以惰性電極電解X溶液的離子方程式_________________________________。 (4)試根據B、Y與氧氣反應過程中的量的變化關系,設計一個實驗,不用實驗室里的任何試劑,只用常用的儀器,區分B、Y兩種物質(簡要說明實驗方法和實驗結論) __________________________________________________________________________。 五.(本題包括1小題,共10分) 試題詳情
21.(10分)對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系。 試題詳情
若25℃時有HA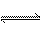 H++A―,則K== H++A―,則K== 式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。 酸 電離方程式 電離平衡常數K CH3COOH 試題詳情
CH3COOH CH3COO―+H+ CH3COO―+H+ 試題詳情
試題詳情
H2CO3 H++HCO3― H++HCO3― 試題詳情
HCO3― H++CO32― H++CO32― 試題詳情
試題詳情
試題詳情
H2S H++HS― H++HS― 試題詳情
HS― H++S2― H++S2― 試題詳情
試題詳情
試題詳情
H3PO4 H++H2PO4― H++H2PO4― 試題詳情
H2PO4― H++HPO42― H++HPO42― 試題詳情
HPO42― H++PO43― H++PO43― 試題詳情
試題詳情
試題詳情
K3==2.20×10―13 回答下列各題: (1)K只與溫度有關,當溫度升高時,K值__________(填“增大”、“減小”、“不變”)。 (2)在溫度相同時,各弱酸的K值不同,那么K值的大小與酸性的相對強弱有何關 系?_____________________________。 (3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最強的是__________,最弱的是_____________。 (4)多元弱酸是分步電離的,每一步都有相應的電離平衡常數,對于同一種多元弱酸的K1、K2、K3之間存在著數量上的規律,此規律是________________,產生此規律的原因是___________________________________。 六.(本題包括2小題,共18分) 試題詳情
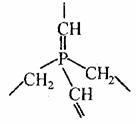 22. (8分)(I) 假若某大分子,分子內只含 C、H、P三種元素,其最 22. (8分)(I) 假若某大分子,分子內只含 C、H、P三種元素,其最
小的重復的結構單元如右圖當該化合物分子中含n個磷原子 時,則該化合物的組成可表示為__________。 (II)甘油松香酯是應用最廣泛的一種松香酯,俗稱酯膠,是由甘油 與松香反應而得的。松香的結構簡式如圖1所示: 試題詳情
試回答下列問題: (1)試寫出松香的化學式: (2)若1mol松香分子與1mol Br2反應,再在NaOH的醇溶液中發生反應后,再酸化可得如圖2所示的物質。試寫出松香分子與Br2反應生成的產物的結構簡式:
; (3)若已知苯環側鏈上的第一個碳原子上有氫原子的話,不論側鏈有多長,都會被酸性高錳酸鉀氧化成羧基,則如圖3所示的物質在酸性高錳酸鉀溶液中充分反應后的產物中含有苯環結構的物質的結構簡式為:
。 試題詳情
23.(10分)航員佩戴頭盔的盔殼由聚碳酸酯制成,具有隔音、隔熱、防碰撞、減震性好、質量小等特點。已知:(1)苯酚分子中與酚羥基直接相連的碳原子的鄰、對位上的氫原子有很好的反應活性,易跟某些含羰基的化合物
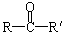 (R、R'代表烷基或H原子)發生縮合反應生成新的有機物和水。 (R、R'代表烷基或H原子)發生縮合反應生成新的有機物和水。 (2)苯酚還能發生如下反應生成有機酸酯: 試題詳情
| 
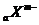 和
和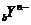 具有相同的電子層結構,若
具有相同的電子層結構,若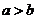 ,則
,則