
【題目】根據要求回答下列有關問題。
(1)甲醇是一種重要的化工原料,工業上利用CO2和H2在一定條件下反應合成甲醇。已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:___。
(2)高爐煉鐵是冶煉鐵的主要方法,發生的主要反應為:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶煉鐵反應的平衡常數表達式K=__,溫度升高后,K值__(填“增大”、“不變”或“減小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶煉鐵反應的平衡常數表達式K=__,溫度升高后,K值__(填“增大”、“不變”或“減小”)。
(3)在T℃時,反應Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常數K=64,在2L恒容密閉容器中,按下表所示加入物質,經過一段時間后達到平衡。
2Fe(s)+3CO2(g)的平衡常數K=64,在2L恒容密閉容器中,按下表所示加入物質,經過一段時間后達到平衡。
Fe2O3 | CO | Fe | CO2 | |
始態mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡時CO 的轉化率為___。
②下列情況標志反應達到平衡狀態的是__(填字母)。
a.容器內氣體密度保持不變
b.容器內氣體壓強保持不變
c.CO的消耗速率和CO2的生成速率相等
d.容器內氣體的平均相對分子質量保持不變
【答案】CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-442.8kJ·mol-1 K=![]() 減小 60% ad
減小 60% ad
【解析】
(1)甲醇不完全燃燒生成一氧化碳和液態水的化學方程式為:CH3OH(l)+O2(g)=CO(g)+2H2O(l),根據蓋斯定律計算反應熱;
(2)平衡常數等于生成物的濃度系數次冪之積除以反應物濃度系數次冪之積;根據溫度對平衡移動的影響判斷溫度對平衡常數的影響
(3)①濃度商Qc=1,小于平衡常數,反應向正反應進行,利用三段式表示出平衡時各組分的物質的量濃度,根據平衡常數列方程計算,在結合轉化率定義計算;
②根據平衡時正逆反應速率相等,各組分的含量不變進行判斷。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
甲醇不完全燃燒生成一氧化碳和液態水的化學方程式為:CH3OH(l)+O2(g)=CO(g)+2H2O(l) ,反應可由(①②)/2+③×2得到,根據蓋斯定律,該反應的焓變為△H=(△H1△H2)/2+2△H3=442.8kJ/mol,
故答案為:CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-442.8kJ·mol-1;
(2) Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol的平衡常數表達式K=
2Fe(s)+3CO2(g) H=-28.5kJ/mol的平衡常數表達式K=![]() ,該反應是放熱反應,升高溫度平衡逆向進行,平衡常數減小;
,該反應是放熱反應,升高溫度平衡逆向進行,平衡常數減小;
故答案為:K=![]() ;減小;
;減小;
(3)①在T℃時,該反應的平衡常數K=64,容器內濃度商Qc=1,小于平衡常數,反應向正反應進行,設消耗一氧化碳物質的量為x,則:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始量(mol): 1 1
變化量(mol): x x
平衡量(mol): 1x 1+x
反應前后氣體體積不變,可以用物質的量代替濃度計算平衡常數,故(1+x)3/(1x)3=64 ,x=0.6,故CO的轉化率=0.6mol/1mol×100%=60%,
故答案為:60%;
②a. 由于反應物和生成物中都有固體物質參加,且平衡前混合氣體的總質量會變化,只有平衡時混合氣體的總質量才保持不變,密度才不變,a正確;
b. 反應時氣態物質體積保持不變的反應,則反應前后氣態物質的物質的量保持不變,則平衡前后氣體的壓強不變,b錯誤;
c. .CO的消耗速率和CO2的生成速率均為正反應速率,c錯誤;
d. 據平均相對分子質量=氣體總質量/氣體總物質的量,反應中氣體物質的量是定值,只有平衡時,質量才不變,平均相對分子質量才不變,故d正確;
故選ad。


 七星圖書口算速算天天練系列答案
七星圖書口算速算天天練系列答案 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:
【題目】在下列各溶液中,一定能大量共存的離子組是
A.常溫下水電離的c(H+)為1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3-
B.滴加石蕊后呈藍色的溶液中:K+、AlO2-、Cl-、HCO3-
C.使石蕊呈紅色的溶液:NH4+、NO3﹣、AlO2﹣、I﹣
D.常溫下![]() =1014的溶液中:K+、Ba2+、Cl-、Br-
=1014的溶液中:K+、Ba2+、Cl-、Br-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃燒的熱化學方程式分別為:
H2 (g) +![]() O2(g) = H2O (l) △H = -285.8 kJ /mol
O2(g) = H2O (l) △H = -285.8 kJ /mol
CO(g) +![]() O2(g) = CO2(g) △H = -283 kJ /mol
O2(g) = CO2(g) △H = -283 kJ /mol
C8H18 (l) +![]() O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
CH4 (g) + 2O2(g) = CO2(g) + 2H2O (l) △H = -890.3 kJ /mol
相同質量的H2、CO、C8H18、CH4完全燃燒時,放出熱量最少的是
A.H2 (g)B.CO(g)C.C8H18 (l)D.CH4 (g)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳與VA族元素形成的化合物是重要的半導體材料,應用最廣泛的是砷化鎵(GaAs),回答下列問題:
(1)基態Ga原子的核外電子排布式為_____,基態As原子核外有_________個未成對電子。
(2)鎵失去電子的逐級電離能(單位:kJ·mol-1)的數值依次為577、1984.5、2961.8、6192由此可推知鎵的主要化合價為____和+3。砷的電負性比鎳____(填“大”或“小”)。
(3)比較下列鎵的鹵化物的熔點和沸點,分析其變化規律及原因:________________________。
鎵的鹵化物 | GaCl3 | GaBr3 | GaI3 |
熔點/℃ | 77.75 | 122.3 | 211.5 |
沸點/℃ | 201.2 | 279 | 346 |
GaF3的熔點超過1000 ℃,可能的原因___________________________________________。
(4)二水合草酸鎵的結構如圖所示,其中鎵原子的配位數為______,草酸根中碳原子的雜化方式為______________。

(5)砷化鎵熔點為1238℃,立方晶胞結構如圖所示,晶胞參數為a=565 pm。該晶體的類型為_________,晶體的密度為___________(設NA為阿伏加德羅常數的數值,列出算式即可)g·cm-3。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2A+B![]() 3C+5D反應中,表示該反應速率最快的是
3C+5D反應中,表示該反應速率最快的是
A.υ(A)= 0.5 mol/(L·s)B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s)D.υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用0.2000mol·L-1的標準NaOH溶液滴定未知濃度的鹽酸,其操作可分為如下幾步:
① 用蒸餾水洗滌堿式滴定管后立即注入NaOH溶液至“0”刻度線以上;
② 固定好滴定管并使滴定管尖嘴充滿液體;
③ 調節液面至“0”或“0”刻度線稍下,并記下讀數;
④ 量取20.00mL待測液注入潔凈的錐形瓶中,并加入3滴酚酞溶液;
⑤ 用標準液滴定至終點,記下滴定管液面讀數。
請回答:
(1)以上操作步驟中有一步有錯誤,請指出編號___,該錯誤操作會導致測定結果___(填“偏大”、“偏小”或“無影響”)。
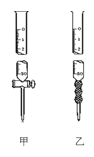
(2)用標準NaOH溶液滴定時,應將標準NaOH溶液注入___中,該儀器的名稱是___。(從圖中選填“甲”或“乙”)
(3)下列操作會引起實驗結果偏大的是:___(填編號)
A.在錐形瓶裝液前,留有少量蒸餾水
B.滴定前,堿式滴定管尖嘴有氣泡,滴定后無氣泡
C.錐形瓶先用蒸餾水洗滌后,再用待測液潤洗
D.用酸式滴定管量取待測液時將一滴待測液滴在錐形瓶外
(4)判斷達到滴定終點的現象是:___。
(5)以下是實驗數據記錄表
滴定次數 | 鹽酸體積(mL) | NaOH溶液的讀數(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.28 |
2 | 20.00 | 0.00 | 18.24 |
通過計算可得,該鹽酸濃度為:___mol·L-1(計算結果保留2位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是![]()
A.![]() 時,將
時,將![]() 的碳酸鈉溶液加水稀釋100倍,所得溶液的
的碳酸鈉溶液加水稀釋100倍,所得溶液的![]()
B.pH相同的鹽酸和醋酸溶液分別與足量鎂粉反應,醋酸產生![]() 體積更大
體積更大
C.![]() 時,
時,![]() 的HA弱酸溶液與
的HA弱酸溶液與![]() 的NaOH溶液等體積混合,所得溶液pH一定小于7
的NaOH溶液等體積混合,所得溶液pH一定小于7
D.![]() 溶液中加入一定量
溶液中加入一定量![]() 晶體,溶液中
晶體,溶液中![]() 增大,可以證明
增大,可以證明![]() 為弱酸
為弱酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于濃度均為0.1 mol/L的三種溶液:①氨水、②鹽酸、③氯化銨溶液,下列說法不正確的是
A. c(NH+4):③>①B. 水電離出的c(H+):②>①C. ①和②等體積混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等體積混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等體積混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I2在KI溶液中存在平衡I2(aq)+I(aq)=I3—(aq)。某I2、KI混合溶液中,I3—的物質的量濃度c(I3—)與溫度T的關系如圖所示(曲線上的任何點都表示平衡狀態)。下列說法正確的是
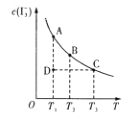
①I2(aq)+I—(aq)=I3—(ag) ΔH>0
②若溫度為T1、T2時反應的平衡常數分別為K1、K2,則K1>K2
③若反應進行到狀態D時,一定有v正>v逆
④狀態A與狀態B相比,狀態A的c(I2)大
⑤保持溫度不變,向該混合溶液中加水,![]() 將變大
將變大
A. 只有①②B. 只有②③C. ①③④D. ①③⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com