
【題目】已知四種元素A、B、C、D,其原子序數依次增大,最外層電子數依次為4、1、2、7,其中A元素原子次外層電子數為2,B、C 兩元素的原子次外層電子數為8,B元素原子最外層電子數比第1層電子數少1,也比C元素原子第M層電子數少1,D元素的單質為液態非金屬單質。若此四種元素均位于元素周期表前四個周期,請按要求填寫下列各題:
(1)A原子的原子結構示意圖為_____,D元素在元素周期表中的位置為______。
(2)B元素的最高價氧化物對應的水化物用電子式表示為______________,C、D兩元素形成的化合物化學鍵類型為__________。
(3)請寫出D元素的單質與SO2同時通入水中反應的化學方程式:___________。
【答案】 ![]() 第四周期第ⅦA族
第四周期第ⅦA族 ![]() 離子鍵 Br2+SO2+2H2O=2HBr+H2SO4
離子鍵 Br2+SO2+2H2O=2HBr+H2SO4
【解析】試題分析:A元素原子次外層電子數為2,最外層電子數是4,所以A為C元素;B、C 兩元素的原子次外層電子數為8,B元素原子最外層電子數比第1層電子數少1,則B為三層電子,為Na元素;也比C元素原子第M層電子數少1,C的最外層電子數是2,B的最外層電子數是1,則C的M層電子數是2,即M是最外層,所以C是Mg元素;D元素的單質為液態非金屬單質,則D是Br元素。
(1)C元素的原子結構示意圖為![]() ,Br元素在元素周期表中位于第四周期第VIIA族;
,Br元素在元素周期表中位于第四周期第VIIA族;
(2)Na元素的最關鍵氧化物的水化物hi氫氧化鈉,為離子化合物,所以其電子式是![]() ;Br為活潑非金屬,而Mg屬于活潑金屬,二者易形成離子化合物,化學鍵類型為離子鍵;
;Br為活潑非金屬,而Mg屬于活潑金屬,二者易形成離子化合物,化學鍵類型為離子鍵;
(3)溴單質與二氧化硫同時通入水中,則發生氧化還原反應,生成兩種強酸,化學方程式是Br2+SO2+2H2O=2HBr+H2SO4。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、W、Q、R是7種短周期元素,其原子半徑及主要化合價如下:
元素代號 | X | Y | Z | M | W | Q | R |
原子半徑/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合價 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金屬性最強的在周期表中的位置是________________________________;X、Y、Q各自形成的簡單離子中,離子半徑由大到小的順序是_______(填離子符號)。
W和R按原子個數比1﹕4構成的陽離子所含的化學鍵是____________________。
(2)表中所列4種第三周期元素的最高價氧化物的水化物堿性最弱的是_______(填化學
式),其電離方程式為_____________________________________。
(3)M與Z相比,非金屬性較強的是_____________(填元素名稱),請從原子結構的角度說明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能發生氧化還原反應,反應方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
請配平,當有0.5 mol H2O2參加此反應,電子轉移的個數為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定質量的AlCl3和MgCl2混合溶液中逐漸滴入一定溶質質量分數的NaOH溶液,生成沉淀的物質的量與加入NaOH的物質的量的關系如圖所示,則:
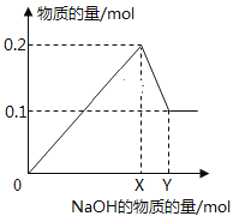
(1)O-X段反應的離子方程式為:________________________,
(2)X-Y段反應的離子方程式為_________________________
(3)生成Mg(OH)2的質量為___________________g;
(4)X=________________;Y=______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入適量FeCl3溶液,不同時刻測得生成O2的體積(已折算為標準狀況)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
資料顯示,反應分兩步進行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反應過程中能量變化如右圖所示。下列說法不正確的是

A. 0~6 min的平均反應速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快過氧化氫的分解速率
C. 反應①是吸熱反應、反應②是放熱反應
D. 反應2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿性電池具有容量大、放電電流大的特點,因而得到廣泛應用.鋅﹣錳堿性電池以氫氧化鉀溶液為電解液,電池總反應式為:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列說法錯誤的是( )
Zn(OH)2(s)+Mn2O3(s) 下列說法錯誤的是( )
A. 電池工作時,鋅失去電子
B. 電池正極的電極反應式為:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 電池工作時,電子由正極通過外電路流向負極
D. 外電路中每通過0.2mol電子,鋅的質量理論上減小6.5g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)反應Fe+H2SO4=FeSO4+H2↑的能量變化趨勢,如圖所示:

①該反應為________反應(填“吸熱”或“放熱”)。
②若要使該反應的反應速率加快,下列措施可行的是________(填字母)。
A.改鐵片為鐵粉 B.改稀硫酸為98%的濃硫酸 C.升高溫度
(2)美國阿波羅宇宙飛船上使用了一種新型燃料電池,其構造如圖所示,A、B兩個電極均由多孔的碳塊組成,該電池的正極反應式為:_______________________________。

(3)300 ℃時,將A和B兩種氣體混合于恒容密閉容器中,發生如下反應:3A(g)+B(g)![]() 2C(g)+2D(g),2 min末達到平衡。
2C(g)+2D(g),2 min末達到平衡。
①300℃時,該反應的平衡常數表達式為K=________。
②已知K300℃<K350℃,則ΔH____0(填“>”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在常溫下,Fe與水并不發生反應,但在高溫下,Fe與水蒸氣可發生反應。高溫下Fe與水蒸氣的反應實驗應使用如圖所示的裝置,在硬質玻璃管中放入鐵粉和石棉絨的混合物,通入水蒸氣并加熱。請回答實驗的相關問題。
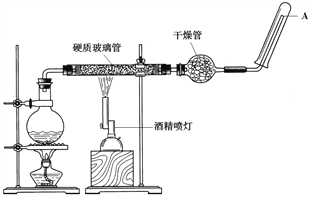
(1)該反應的反應方程式為_________。
(2)圓底燒瓶中裝的是水,該裝置的主要作用是______________;燒瓶底部放了幾片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛裝的物質是____________,作用是________________________。
(4)如果要在A處玻璃管口點燃該氣體,則必須對該氣體進行____________,方法是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某班同學用如下實驗探究Fe2+、Fe3+的性質。回答下列問題:
(1)分別取一定量氯化鐵、氯化亞鐵固體,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量鐵屑,其目的是___________。
(2)甲組同學取2 mL FeCl2溶液,加入幾滴氯水,再加入1滴KSCN溶液,溶液變紅,說明Cl2可將Fe2+氧化。FeCl2溶液與氯水反應的離子方程式為____________。
(3)乙組同學認為甲組的實驗不夠嚴謹,該組同學在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入幾滴氯水和1滴KSCN溶液,溶液變紅,煤油的作用是_____。
(4)丙組同學取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分別取2 mL 此溶液于3支試管中進行如下實驗:
①第一支試管中加入1 mL CCl4充分振蕩、靜置,CCl4層顯紫色;
②第二支試管中加入1滴K3[Fe(CN)6]溶液,生成藍色沉淀;
③第三支試管中加入1滴KSCN溶液,溶液變紅。
實驗②檢驗的離子是____(填離子符號);實驗①和③說明:在I-過量的情況下,
溶液中仍含有___(填離子符號),由此可以證明該氧化還原反應為________。
(5)丁組同學向盛有H2O2溶液的試管中加入幾滴酸化的FeCl2溶液,溶液變成棕黃色,發生反應的離子方程式為___________________;一段時間后,溶液中有氣泡出現,并放熱,隨后有紅褐色沉淀生成。產生氣泡的原因是_______________;生成沉淀的原因是__________________(用平衡移動原理解釋)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用一定量的鐵與足量的稀H2SO4及足量的CuO制單質銅,有人設計以下兩種方案:
①Fe ![]() H2
H2 ![]() Cu , ② CuO
Cu , ② CuO ![]() CuSO4
CuSO4 ![]() Cu 。
Cu 。
若實驗過程中,根據一般的實驗方法和實驗操作規則進行操作,則對兩者制得單質銅的量作比較,正確的是
A. 相等 B. ①多 C. ②多 D. 無法判斷
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com