
【題目】銅及其化合物在工業生產上有許多用途。某工廠以輝銅礦(主要成分為Cu2S,含少量Fe2O3、SiO2等雜質)為原料制備不溶于水的堿式碳酸銅的流程如圖:

(1)加快“浸取”速率除將輝銅礦粉碎外,還可采取的措施有_________ (任寫一種);研究發現若先除鐵再浸取,浸取速率明顯變慢,其可能原因是________。
(2)濾渣I中的主要成分是MnO2、S、SiO2。請寫出“浸取”反應中生成S的化學方程式:________。
(3)常溫下“除鐵”時加入的試劑A可用____________較為合適,若加A后溶液的pH調為5,則溶液中Fe3+ 的濃度為______mol/L。{Ksp[Fe(OH)3]=4.0×10- 38}
(4)寫出“沉錳"(除Mn2+ )過程中反應的離子方程式:______。
(5)“趕氨”時,最適宜的操作方法是__________。
(6)濾液II經蒸發結晶得到的鹽主要是________(寫化學式)。
【答案】適當提高硫酸的濃度或適當加熱或充分攪拌 Fe3+可催化Cu2S被MnO2氧化 2MnO2+Cu2S+4H2SO4=S↓+ 2CuSO4+2MnSO4+4H2O CuO ![]() Mn2++HCO3-+NH3=MnCO3↓+NH4+ 將溶液加熱 (NH4)2SO4
Mn2++HCO3-+NH3=MnCO3↓+NH4+ 將溶液加熱 (NH4)2SO4
【解析】
輝銅礦主要成分為Cu2S,含少量Fe2O3、SiO2等雜質,加入稀硫酸和二氧化錳浸取,過濾得到濾渣為為二氧化錳、二氧化硅和單質硫,濾液中含有鐵離子、錳離子和銅離子,調節溶液pH除去鐵離子,加入碳酸氫銨溶液沉淀錳,過濾得到濾液,趕出氨氣循環使用,得到堿式碳酸銅。
(1)加快“浸取”速率除將輝銅礦粉碎外,還可以適當提高硫酸的濃度、適當加熱、充分攪拌等,浸取時,Fe2O3和稀硫酸反應生成硫酸鐵和水,Fe2O3起媒介作用,Fe3+可催化Cu2S被MnO2氧化,若先除鐵再浸取,浸取速率明顯變慢,故答案為:適當提高硫酸的濃度或適當加熱或充分攪拌;Fe3+可催化Cu2S被MnO2氧化;
(2)濾渣I中的主要成分是MnO2、S、SiO2。“浸取”反應中生成S的化學方程式為:2MnO2+Cu2S+4H2SO4=S↓+ 2CuSO4+2MnSO4+4H2O,故答案為:2MnO2+Cu2S+4H2SO4=S↓+ 2CuSO4+2MnSO4+4H2O;
(3)常溫下“除鐵”時加入的試劑A可用CuO較為合適,已知Ksp[Fe(OH)3]=4.0×10- 38,pH=5,則c(H+)=10-5,c(OH-)=10-9,Ksp[Fe(OH)3]=![]() 4.0×10- 38,
4.0×10- 38,![]() mol/L,故答案為:CuO;
mol/L,故答案為:CuO;![]() ;
;
(4)“沉錳"過程中加入碳酸氫銨和氨氣,生成碳酸錳,其離子方程式為:Mn2++HCO3-+NH3=MnCO3↓+NH4+,故答案為:Mn2++HCO3-+NH3=MnCO3↓+NH4+;
(5)“趕氨”時,最適宜的操作方法是減小氨氣溶解度,氨氣是易揮發性氣體,加熱驅趕,故答案為:將溶液加熱;
(6)濾液II主要是硫酸銨溶液,通過蒸發濃縮、冷卻結晶、過濾洗滌得到硫酸銨晶體,故答案為:(NH4)2SO4。


 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.pH=l的溶液中:Ba2+、Fe3+、Cl-、SCN-
B.能使酚酞變紅的溶液:Ca2+、K+、HCO3-、CO32-
C.![]() =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.由水電離的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國對二氧化硫一空氣質子交換膜燃料電池的研究處于世界前沿水平,該電池可實現硫酸生產、發電和環境保護三位一.體的結合。其原理如圖所示。下列說法不正確的是( )
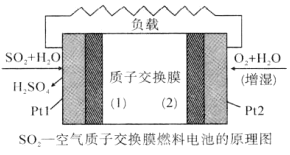
A.Pt1電極附近發生的反應為:SO2+2H2O-2e-=H2SO4+2H+
B.相同條件下,放電過程中消耗的SO2和O2的體積比為2:1
C.該電池工作時質子從Pt1電極經過內電路流到Pt2電極
D.該電池實現了制硫酸、發電、環保三位一體的結合
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在-50℃時液氨中存在著下列平衡:2NH3(液)![]() NH4++NH2-,兩種離子的平衡濃度均為1.0×10-15mol·L-1。以下有關-50℃時離子積的敘述中正確的是( )
NH4++NH2-,兩種離子的平衡濃度均為1.0×10-15mol·L-1。以下有關-50℃時離子積的敘述中正確的是( )
A. 離子積為1.0×10-15
B. 離子積為1.0×10-30
C. 向液氨中加入氨基鈉(NaNH2),液氨的離子積增大
D. 向液氨中加入NH4Cl,c(NH4+)增大,離子積的數值也隨之增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個定容的密閉容器中進行如下反應:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反應過程中的某一時間SO2、O2和SO3的濃度分別為0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。當反應達平衡時不可能存在的數據正確的是
2SO3(g)。已知反應過程中的某一時間SO2、O2和SO3的濃度分別為0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。當反應達平衡時不可能存在的數據正確的是
A. c(SO2)=0.25 mol·L-1 B. c(O2)=0.12 mol·L-1
C. c(SO2)+c(SO3)=0.15 mol·L-1 D. c(SO3)+c(O2)=0.3 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】自然界中的許多植物中含有醛,其中有些具有特殊香味,可作為植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。則下列說法中錯誤的是( )
)。則下列說法中錯誤的是( )
A.肉桂醛和苯甲醛互為同系物
B.苯甲醛分子中所有原子可能位于同一平面內
C.肉桂醛能發生加成反應、取代反應和加聚反應
D.與肉桂醛互為同分異構體且含相同官能團和苯環結構的共有4種(不考慮順反異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述正確的是( )
A.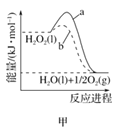 圖甲表示H2O2在有、無催化劑下的分解反應能量變化曲線,b表示有催化劑時的反應
圖甲表示H2O2在有、無催化劑下的分解反應能量變化曲線,b表示有催化劑時的反應
B. 圖乙表示0.1molMgCl26H2O在空氣中充分加熱時固體質量隨時間的變化
圖乙表示0.1molMgCl26H2O在空氣中充分加熱時固體質量隨時間的變化
C.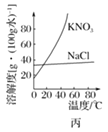 圖丙表示KNO3和NaCl的溶解度曲線,若欲除去NaCl中少量KNO3,可將混合物制成較高溫度下的濃溶液再冷卻結晶、過濾
圖丙表示KNO3和NaCl的溶解度曲線,若欲除去NaCl中少量KNO3,可將混合物制成較高溫度下的濃溶液再冷卻結晶、過濾
D.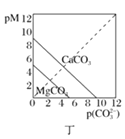 圖丁表示碳酸鹽的溶解平衡曲線[pM=-lgc(M),p(CO32-)=-lgc(CO32-)],則Ksp(CaCO3)>Ksp(MgCO3)
圖丁表示碳酸鹽的溶解平衡曲線[pM=-lgc(M),p(CO32-)=-lgc(CO32-)],則Ksp(CaCO3)>Ksp(MgCO3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】莫爾法是用硝酸銀標準溶液測定鹵離子含量的沉淀滴定法。某實驗興趣小組將無水FeCl3與氯苯混合發生反應:2FeCl3 +C6H5Cl![]() 2FeCl2 +C6H4Cl2+HC1↑,將生成的HCl用水吸收,利用莫爾法測出無水FeCl3的轉化率,同時得到常用的還原劑FeCl2。按照如圖裝置:
2FeCl2 +C6H4Cl2+HC1↑,將生成的HCl用水吸收,利用莫爾法測出無水FeCl3的轉化率,同時得到常用的還原劑FeCl2。按照如圖裝置:
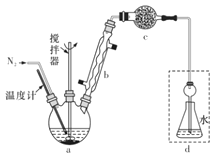
在三頸燒瓶中放入162.5g無水FeCl3與225 g氯苯,控制反應溫度在130℃下加熱3 h,冷卻、過濾,洗滌、干燥得到粗產品。有關數據如表:
C6H5Cl | C6H4Cl2 | AgCl | Ag2CrO4 | |
顏色 | — | — | 白色 | 磚紅色 |
溶度積 | — | — | 1.56×10-10 | 9×10-12 |
熔點/℃ | -45 | 53 | — | — |
沸點/℃ | 132 | 173 | — | — |
回答下列問題:
(1)儀器c的名稱是_______,盛裝的試劑可以是_______________(填字母代號)。
A.堿石灰 B,濃硫酸 C.無水氯化鈣 D.固體氫氧化鈉
(2)下列各裝置(盛有蒸餾水)能代替圖中虛線框內部分的是______(填字母代號)。
e.  f.
f.  g.
g.  h.
h. 
(3)如何從濾液中回收過量的氯苯:__________。
(4)將錐形瓶內的溶液稀釋至1 000 mL,從中取出10. 00 mL,滴加幾滴K2CrO4 作指示劑,用0. 200 0 mol/L AgNO3溶液進行滴定,當達到終點時平均消耗22. 50 mL AgNO3溶液。
①滴定終點的現象是________,使用棕色滴定管進行滴定的目的是_________。
②無水FeCl3的轉化率α=_______
③上述滴定完成時,若滴定管尖嘴處留有氣泡會導致測定結果偏________(填“高”或“低”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與社會、生活密切相關。下列說法錯誤的是( )
A.蠶絲屬于天然高分子材料
B.霧霾紀錄片《穹頂之下》,提醒人們必須十分重視環境問題,提倡資源的“3R”利用,即:減少資源消耗(Reduce)、增加資源的重復使用(Reuse)、提高資源的循環利用(Recycle)
C.化石燃料完全燃燒不會造成大氣污染
D.中國古代用明礬溶液清洗銅鏡表面的銅銹
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com