
根據下列條件計算有關反應的焓變:
(1)已知:Ti(s)+2Cl2(g)=TiCl4(l)ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)=2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)=Na(l) ΔH=+2.6 kJ·mol-1
則反應TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH=________ kJ·mol-1。
(2)已知下列反應數值:
反應序號 | 化學反應 | 反應熱 |
① | Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol- |
③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | ΔH4 |
則反應④的ΔH4=____________ kJ·mol-1。
(1)-970.2 (2)+7.3
【解析】(1)由已知反應得:
TiCl4(l)=Ti(s)+2Cl2(g) ΔH=+804.2 kJ·mol-1①
4Na(s)+2Cl2(g)=4NaCl(s) ΔH=-1764.0 kJ·mol-1②
4Na(s)=4Na(l) ΔH=+10.4 kJ·mol-1。③
根據蓋斯定律,將①+②-③得:TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s) ΔH=+804.2 kJ·mol-1-1 764.0 kJ·mol-1-10.4 kJ·mol-1=-970.2 kJ·mol-1。
(2)根據蓋斯定律,將(①×3-②-③×2)/6得:FeO(s)+CO(g)=Fe(s)+CO2(g),則ΔH4=(ΔH1×3-ΔH2-ΔH3×2)/6≈+7.3 kJ·mol-1。


 寒假創新型自主學習第三學期寒假銜接系列答案
寒假創新型自主學習第三學期寒假銜接系列答案科目:高中化學 來源:2014高考化學二輪專題突破 專題六物質結構和元素周期律練習卷(解析版) 題型:選擇題
某礦石由前20號元素中的4種組成,其化學式為WmYnZpXq。X、Y、Z、W分布在三個周期,原子序數依次增大,W、Y為金屬元素,X原子的最外層電子數是次外層電子數的3倍,W單質能與冷水劇烈反應,Y、Z原子的最外層電子數之和與X、W原子的最外層電子數之和相等,Y、Z位于同周期,Z單質是一種良好的半導體。下列說法正確的是( )
A.氣態氫化物的穩定性:X<Z
B.含有1 mol Y的氯化物的水溶液中離子總數為4 mol(不考慮水的電離)
C.W位于第三周期ⅠA族,其原子半徑比其他元素的都大
D.2 mol W單質和1 mol Y單質投入足量的水中會產生2.5 mol氣體
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題二化學用語及常用計量練習卷(解析版) 題型:選擇題
下列化學用語表達正確的是( )
A.Na2S的電子式:
B.銫?137:137Cs
C.O2-的結構示意圖: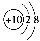
D.乙烯分子的球棍模型: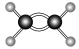
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:計算題
試回答下列問題。
(1)已知24 g A和40 g B恰好完全反應生成0.4 mol C和32 g D,則C的摩爾質量為________。
(2)把1 mol Na和1 mol Mg分別投入到等量且過量的鹽酸中,分別得到溶液a和b,則溶液a和b的質量關系為ma________mb。
(3)如圖為實驗室某濃鹽酸試劑瓶的標簽上的有關數據,試根據標簽上的有關數據回答下列問題:

①該濃鹽酸中HCl的物質的量濃度為______ mol·L-1。
②標準狀況下,1.00 L水(密度為1.00 g·cm-3)吸收________ L的HCl可制得上述濃鹽酸。
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題三溶液組成的計量及其應用練習卷(解析版) 題型:選擇題
一定量的銅和濃硫酸在加熱條件下充分反應,向反應后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反應后的溶液呈中性,則下列敘述錯誤的是( )
A.溶液中c(Na+)=2c(SO42-)
B.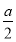 mol>沉淀的物質的量>0
mol>沉淀的物質的量>0
C.沉淀的物質的量=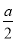 mol
mol
D.原濃硫酸中H2SO4的物質的量>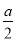 mol
mol
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題七化學反應與能量練習卷(解析版) 題型:選擇題
某一化學反應在不同條件下的能量變化曲線如下圖所示。下列說法正確的是( )
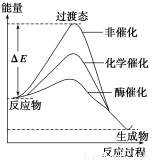
A.化學催化比酶催化的效果好
B.使用不同催化劑可以改變反應的熱效應
C.使用不同催化劑可以改變反應的能耗
D.反應物的總能量低于生成物的總能量
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題七化學反應與能量練習卷(解析版) 題型:選擇題
將盛有NH4HCO3粉末的小燒杯放入盛有少量醋酸的大燒杯中。然后向小燒杯中加入鹽酸,反應劇烈,醋酸逐漸凝固。由此可見 ( )
A.NH4HCO3和鹽酸的反應是放熱反應
B.該反應中,熱能轉化為產物內部的能量
C.反應物的總能量高于生成物的總能量
D.反應的熱化學方程式為NH4HCO3+HCl―→NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1
查看答案和解析>>
科目:高中化學 來源:2014高考化學專題突破訓練 專題9金屬及其化合物練習卷(解析版) 題型:填空題
由Fe2O3、Fe、CuO、C、Al中的幾種物質組成的混合粉末,取樣品進行下列實驗(部分產物略去):
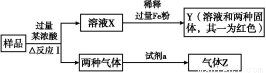
(1)取少量溶液X,加入過量的NaOH溶液,有沉淀生成。取上層清液,通入CO2,無明顯變化,說明樣品中不含有的物質是(填寫化學式) 。
(2)Z為一種或兩種氣體:
①若Z只為一種氣體,試劑a為飽和NaHCO3溶液,則反應Ⅰ中能同時生成兩種氣體的化學方程式是 。
②若Z為兩種氣體的混合物,試劑a為適量水,則Z中兩種氣體的化學式是 。
(3)向Y中通入過量氯氣,并不斷攪拌,充分反應后,溶液中的陽離子是(填寫離子符號) 。
(4)取Y中的溶液,調pH約為7,加入淀粉KI溶液和H2O2,溶液呈現藍色并有紅褐色沉淀生成。當消耗2 mol I-時,共轉移3 mol電子,該反應的離子方程式是 。
(5)另取原樣品,加入足量稀硫酸充分反應。若溶液中一定不會產生Y中的紅色固體,則原樣品中所有可能存在的物質組合是(各組合中的物質用化學式表示) 。
查看答案和解析>>
科目:高中化學 來源:2014高考化學專題突破訓練 專題6化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
煤氣是生活中常用的燃料,制取水煤氣的反應為C(s)+H2O(g) CO(g)+H2(g)。該反應在一容積可變的密閉容器中進行時,改變下列條件會對反應速率產生影響的是( )
CO(g)+H2(g)。該反應在一容積可變的密閉容器中進行時,改變下列條件會對反應速率產生影響的是( )
①增加碳的量 ②將容器的體積縮小一半 ③保持體積不變,充入N2使體系壓強增大 ④保持壓強不變,充入N2使體系體積增大
A.①② B.②③ C.②④ D.①④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com