
【題目】鹵素單質在堿性溶液中容易發生歧化反應,歧化的產物依反應溫度的不同而不同。
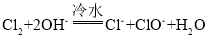 、
、![]()
下圖為制取氯氣、氯酸鉀、次氯酸鈉和檢驗氯氣性質的微型實驗裝置:
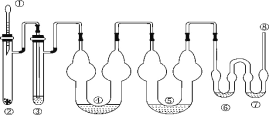
裝置中盛裝的藥品如下:
①膠頭滴管中裝有 5 mL 濃鹽酸;②微型具支試管中裝有 1.5 g KMnO4;③微型具支試管中裝有 2~3 mL 濃硫酸;④U 形反應管中裝有 30% KOH 溶液;⑤U 形反應管中裝有 2 mol·L-1 NaOH 溶液;⑥、⑦雙 U 形反應管中分別裝有 0.1 mol·L-1 KI-淀粉溶液和 KBr 溶液;⑧尾氣出口用浸有 0.5 mol·L-1 Na2S2O3 溶液的棉花輕輕覆蓋住
(1)檢查整套裝置氣密性的方法是_________。
(2)為了使裝置④⑤中的反應順利完成,應該控制的反應條件分別為_______、_______。
(3)裝置⑥⑦中能夠觀察到的實驗現象分別是_________, _______。
(4)如果把裝置⑥⑦中的試劑互換位置,則______(填“能”或“不能”)證明氧化性 Cl2>I2,理由是________。
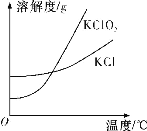
(5)已知氯酸鉀和氯化鉀的溶解度曲線如圖所示,反應結束后,從裝置④所得溶液中提取氯酸鉀晶體的實驗操作是________。
(6)尾氣處理時 Cl2 發生反應的離子方程式為_________。
(7)選擇微型實驗裝置的優點有____________(任答兩點)。
【答案】連接好實驗裝置,由⑧導管向⑦裝置中加水,若能形成一段穩定的水柱,則裝置的氣密性良好 裝置④放入348K熱水浴中 裝置⑤放入冰水浴中 裝置⑥中溶液變藍 裝置⑦中溶液變成橙色 能 Cl2與KBr反應生成的Br2,氧化性Cl2>Br2,Cl2與揮發出來的Br2均可與KI反應,氧化性Br2>I2或Cl2>I2,均可證明氧化性Cl2>I2 蒸發濃縮、冷卻結晶、過濾(洗滌、干燥) S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ 簡化實驗裝置、節約成本;試劑用量少、能源消耗少;節省空間,縮短實驗時間;減少污染等
【解析】
(1)連接好實驗裝置,可用液差法檢查整套裝置的氣密性,具體方法為:連接好實驗裝置,由⑧導管向⑦裝置中加水,若能形成一段穩定的水柱,則裝置的氣密性良好;
(2)④U形反應管中裝有30%KOH溶液,用于制取氯酸鉀,反應溫度是348K,⑤U形反應管中裝有2mol/LNaOH溶液用于制取次氯酸鈉,反應條件是冷水中,所以裝置④放入348K熱水浴中,裝置⑤放入冰水浴中,故答案為:裝置④放入348K熱水浴中;裝置⑤放入冰水浴中;
(3)裝置⑥中KI溶液與Cl2反應生成I2,使淀粉溶液變藍,裝置⑦中KBr溶液與Cl2反應生成Br2,溴水呈橙黃色,故答案為:裝置⑥中溶液變藍;裝置⑦中溶液變成橙色;
(4)如果把裝置⑥、⑦中的試劑互換位置,Cl2與KBr反應生成的Br2揮發出來會與KI反應生成I2,根據氧化性:Cl2>Br2>I2,仍然可得到氧化性:Cl2>I2,不影響實驗結論。故答案為:能;Cl2與KBr反應生成的Br2,氧化性Cl2>Br2,Cl2與揮發出來的Br2均可與KI反應,氧化性Br2>I2或Cl2>I2,均可證明氧化性Cl2>I2;
(5)根據溶解度曲線,KClO3的溶解度隨溫度的變化較快,KCl的相對平緩,所以析出KClO3晶體可選擇冷卻結晶,使KCl析出少或不析出,最后過濾、洗滌、干燥得到KClO3晶體,故答案為:蒸發濃縮、冷卻結晶、過濾;
(6)尾氣處理時,Na2S2O3和Cl2發生氧化還原反應生成Na2SO4和NaCl,反應的離子方程式為S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故答案為:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(7)微型實驗裝置可簡化實驗裝置、節約成本;試劑用量少、能源消耗少;節省空間,縮短實驗時間,減少污染等,故答案為:簡化實驗裝置、節約成本;(或試劑用量少、能源消耗少;或節省空間,縮短實驗時間,減少污染等)。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】A、B、C、D、E是元素周期表前四周期中的常見元素,原子序數依次增大,相關信息如下:(NA為阿伏加德羅常數的值),請用化學用語回答下列
元素 | 相關信息 |
A | 基態原子的價電子排布式為nsnnpn |
B | 元素原子的核外p電子數比s電子數少1個 |
C | 最外層電子數是電子層數的3倍 |
D | 簡單離子是第三周期元素中離子半徑最小的 |
E | 價電子層中的未成對電子數為4 |
(1)寫出D元素在周期表的位置___,基態E2+價電子的排布圖為___,B元素能量最高的電子其軌道呈__形。
(2)A與C形成的最高價化合物,中心原子軌道雜化類型為__。
(3)A、B、C三種基態原子的第一電離能由大到小的順序為___,B、C、D簡單離子的半徑由大到小的順序為___。
(4)寫出C的核外有18個電子的氫化物的電子式___。
(5)E可用做某些反應的催化劑,CO易導致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔點為-20℃,沸點為103℃,易溶于乙醚,其晶體類型為___。
(6)已知沸點:B2H4>A2H6,主要原因為________。
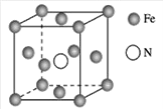
(7)鐵的多種化合物均為磁性材料,氮化鐵是其中一種,某氮化鐵的晶胞結構如圖所示,則氮化鐵的化學式為___
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法不正確的是(阿伏伽德羅常數為NA)( )
A.氯氣跟水反應的離子方程式:Cl2+H2O=2H++Cl-+ClO-
B.15.6克Na2O2中所含的離子總數為0.6NA
C.11克D218O中含有的中子數為6NA
D.![]() 和
和![]() 質子數相同,但屬于不同種核素
質子數相同,但屬于不同種核素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有短周期主族元素X、Y、Z、R、T,R原子最外層電子數是電子層數的2倍;Y與Z能形成Z2Y、Z2Y2型離子化合物,Z與T形成的Z2T型化合物能破壞水的電離平衡,五種元素的原子半徑與原子序數的關系如圖所示。下列推斷正確的是( )
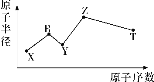
A.原子半徑和離子半徑均滿足:Y<Z
B.簡單氫化物的沸點和熱穩定性均滿足:Y>T
C.最高價氧化物對應的水化物的酸性:T<R
D.常溫下,0.1mol·L-1由X、Y、Z、T四種元素組成的化合物的水溶液的pH一定大于1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物 W 在工業上常用作溶劑和香料,其合成方法如下:
![]()
下列說法正確的是
A.N、W 互為同系物B.M 的二氯代物有 8 種結構
C.N 不可能所有原子共平面D.M、N、W 均能發生加成和取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列幾組物質,請將序號填入下列空格內:
A C60和石墨 B 126C和136C C 冰醋酸和乙酸 D CH3CHO與![]() E 甲烷和十二烷 F 乙醇和乙二醇
E 甲烷和十二烷 F 乙醇和乙二醇
①互為同位素的是_________;
②互為同系物的是___________;
③互為同分異構體的是________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】位于前四周期的6種主族元素A、B、C、D、E、F原子序數依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相鄰,且三種元素的原子最外層電子數之和為18。F是其所在周期中最活潑的金屬元素。根據推斷回答下列問題:
(1)A在周期表中的位置_____;寫出A單質的電子式________。
(2)用“>”或“<”填空:
離子半徑 | 非金屬性 | 酸性 | 氫化物的穩定性 |
F+_D2— | A_B | D的最高價氧化物的水化物___E的最高價氧化物的水化物 | C的氫化物__E的氫化物 |
(3)—定條件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相對大小如圖所示。
(x=1,2,3,4)的能量(KJ)相對大小如圖所示。
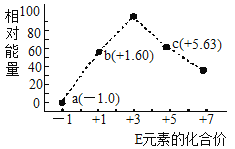
①c點對應的微粒是_______(填離子符號)。
②b→a+c反應的離子方程式為________,該反應是______反應(填“吸熱”或“放熱”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據元素周期表和元素周期律,判斷下列敘述不正確的是

A. 氣態氫化物的穩定性:H2O>NH3>SiH4
B. 氫元素與其他元素可形成共價化合物或離子化合物
C. 上圖所示實驗可證明元素的非金屬性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118號元素在周期表中位于第七周期0族
”(ào)命名的第118號元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物(G)的合成路線如圖:

已知:CH3(CH2)4Br![]() CH3(CH2)3CH2MgBr
CH3(CH2)3CH2MgBr
(1)G中所含的含氧官能團有___、___(寫官能團名稱)。
(2)C→D的反應類型是___;在空氣中久置,A可由白色轉變為橙黃色,其原因是___。
(3)寫出符合下列條件的A的一種同分異構體的結構簡式:___(只寫一種)。
①能發生銀鏡反應,與FeCl3溶液能發生顯色反應;②除苯環外,含有3種不同的官能團;③該分子核磁共振氫譜有5種不同的峰,且峰值比為1∶1∶2∶2∶2。
(4)寫出以苯、乙醇、二甲基甲酰胺為原料制備苯丙酮(![]() )的合成路線流程圖(無機試劑和有機溶劑任用,合成路線流程圖示例見本題題干)。___。
)的合成路線流程圖(無機試劑和有機溶劑任用,合成路線流程圖示例見本題題干)。___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com