
【題目】在半導體工業中有這樣一句話:“從沙灘到用戶”,其中由粗硅制純硅的常用方法為:Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(純)+4HCl。
若在25℃、101kPa條件下反應生成HCl氣體49L,(注:25℃、101kPa條件下氣體摩爾體積為24.5Lmol-1)則:
(1)反應生成HCl氣體的質量為__,轉移電子的總數為___。
(2)反應生成的HCl氣體溶于127mL水中,得到密度為1.20gmL-1的鹽酸,此鹽酸的物質的量濃度為___。
(3)“從沙灘到用戶”涉及多個反應,其中制取粗硅的反應方程式為___。純凈的石英與燒堿反應可以制得水玻璃,反應的離子方程式為__。
(4)普通玻璃若以氧化物形式表示其組成為(質量分數):Na2O13%,CaO11.7%,SiO275.3%。現以石灰石、純堿和石英為原料生產這種玻璃10t,石灰石的利用率為80%,純堿和石英的利用率為95%,至少需耍上述原料的質量是___t。(保留兩位小數)
【答案】73g 4NA 12mol·L-1 SiO2+2C![]() Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O 12.88
Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O 12.88
【解析】
(1)n=![]() =2mol,m=n×M=2mol×36.5g·mol-1=73g;
=2mol,m=n×M=2mol×36.5g·mol-1=73g;
根據方程式:
 可知,反應生成2mol氯化氫消耗1mol氯氣和1mol氫氣,共轉移電子的物質的量為:1mol×2+1mol×2=4mol,故轉移電子個數為4NA;
可知,反應生成2mol氯化氫消耗1mol氯氣和1mol氫氣,共轉移電子的物質的量為:1mol×2+1mol×2=4mol,故轉移電子個數為4NA;
故答案為:73g;4NA;
(2)V=![]() =
=![]() mL=
mL=![]() ×10-3L,C=
×10-3L,C=![]() =
=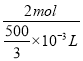 =12mol·L-1;故答案為:12mol·L-1;
=12mol·L-1;故答案為:12mol·L-1;
(3)焦炭與SiO2反應生成Si與CO,反應方程式為:SiO2+2C![]() Si+2CO↑;二氧化硅和氫氧化鈉反應生成硅酸鈉和水,反應的化學方程式為:2NaOH+SiO2═Na2SiO3+H2O,離子方程式為:2OH-+SiO2═SiO32-+H2O;
Si+2CO↑;二氧化硅和氫氧化鈉反應生成硅酸鈉和水,反應的化學方程式為:2NaOH+SiO2═Na2SiO3+H2O,離子方程式為:2OH-+SiO2═SiO32-+H2O;
故答案為:SiO2+2C![]() Si+2CO↑;2OH-+SiO2═SiO32-+H2O;
Si+2CO↑;2OH-+SiO2═SiO32-+H2O;
(4)每天10t,其中含有Na2O質量10t×13%=1.3t,CaO質量10t×11.7%=1.17t,SiO2質量10t×75.3%=7.53t,而Na2O都是從Na2CO3中來,CaO都是從CaCO3中來,SiO2都是從石英中來,根據質量守恒可知設需要石灰石CaCO3質量x,純堿Na2CO3質量y,石英SiO2質量z,則 80%x×=1.17t,即 80%x×![]() =1.17t,解得x≈2.61,95%y×
=1.17t,解得x≈2.61,95%y×![]() =1.3t,即95%y×
=1.3t,即95%y×![]() =1.3t,解得y≈2.34t,95%z=7.53t,解得z≈7.93t,∴共需原料:2.61t+2.34t+7.93t=12.88t;
=1.3t,解得y≈2.34t,95%z=7.53t,解得z≈7.93t,∴共需原料:2.61t+2.34t+7.93t=12.88t;
故答案為:12.88。


 快樂5加2金卷系列答案
快樂5加2金卷系列答案科目:高中化學 來源: 題型:
【題目】一定條件下,體積為10 L的密閉容器中,1 mol X和1 mol Y進行反應:2X(g)+Y(g)![]() Z(g)(正反應為放熱反應)該反應經過60 s時,生成0.3 mol Z,下列說法正確的是( )
Z(g)(正反應為放熱反應)該反應經過60 s時,生成0.3 mol Z,下列說法正確的是( )
A.以X濃度變化表示的反應速率為0.01 mol·(L·s)-1
B.反應經過60 s時一定能達到化學平衡
C.反應放出的熱量可用于提高反應速率
D.反應達到平衡時,n(X):n(Y)=1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是
A. 18g氨基(-ND2)中含有的電子數為10NA
B. 一定質量的乙烷與22.4L(標準狀況)Cl2在光照條件下發生取代反應,形成C-Cl鍵的數目為2NA
C. 用惰性電極電解100mL0.1mol·L-1的CuSO4溶液,當陰、陽兩極產生相同條件下等體積的氣體時,電路中轉移電子數為0.04NA
D. n(H2SO3)和n(HSO3-)之和為1mol的KHSO3溶液中,含有的K+數目為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaCl是我們生活中必不可少的物質。將NaCl溶于水配成1 mol·L-1的溶液,溶解過程如圖所示,下列說法正確的是

A. a離子為Na+
B. 溶液中含有NA個Na+
C. 水合b離子的圖示不科學
D. 室溫下測定該NaCl溶液的pH小于7,是由于Cl-水解導致
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為確定有機物A的結構,某研究團隊對有機物A進行了多項實驗,得實驗結果如下:
①有機物A經李比希法分析知:含碳77.8%,氫為7.40%,其余為氧;
②質譜法分析A得知其相對分子質量為108;
③經紅外光譜測定,A分子結構中含有苯環和羥基;
④A的核磁共振氫譜顯示其有4種峰,且峰面積比為3∶2∶2∶1;
⑤A為無色晶體,常溫下微溶于水;能與燒堿反應,且在常溫下A可與濃溴水反應,1 mol A最多可消耗濃溴水中2 mol Br2。
求:(1)該有機物的分子式為________________。
(2)確定該有機物的結構簡式:___________________,寫出其與足量濃溴水反應的化學方程式:__________。
(3)含有苯環的A的同分異構體還有____________種(不含A),請寫出其中屬于醇的同分異構體與氧氣加熱(銅作催化劑)的反應方程式:______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列敘述正確的是
A. 18 g D2O所含的電子數為10NA
B. 1 mol H2O2中含有極性鍵的數目為3NA
C. 標準狀況下,22.4 L四氯化碳所含分子數為NA
D. 32g O2和O3的混合物中含有的氧原子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列分子或離子中鍵角由大到小排列的是
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤BeCl2
A. ⑤④①②③ B. ④①②⑤③ C. ⑤①④②③ D. ③②④①⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,HA的電離常數Ka=1×10-6,向20 mL濃度為0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH與加入NaOH溶液的體積之間的關系如圖所示,下列說法正確的是( )

A.a點對應溶液的pH約為4,且溶液中只存在HA的電離平衡
B.b點對應溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d點對應溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四點對應的溶液中水的電離程度:a<b<c<d
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z四種短周期元素在元素周期表中的相對位置如圖所示,W的氣態氫化物可與其最高價含氧酸反應生成離子化合物,由此可知

A. X、Y、Z中最簡單氫化物穩定性最弱的是Y
B. Z元素氧化物對應水化物的酸性一定強于Y
C. X元素形成的單核陰離子還原性大于Y
D. Z元素單質在化學反應中只表現氧化性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com