
【題目】現有短周期元素性質的部分數據如下表,其中x的值表示不同元素的原子吸引電子的能力大小,若x值越大,元素的非金屬性越強,金屬性越弱。x值相對較大的元素在所形成的分子中化合價為負。⑩原子的核外電子層數與核外電子總數相同。
元素編號 元素性質 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
x | 3.44 | 2.55 | 0.98 | 3.16 | 2.19 | 3.98 | 0.93 | 3.04 | 1.91 | |
常見化合價 | 最高價 | +4 | +1 | +1 | +4 | |||||
最低價 | -2 | -1 | -3 | -1 | -3 | |||||
(1)根據以上條件,推斷③④⑤的元素符號分別為:___,__,__。
(2)②的最高價氧化物的固體屬于__晶體,空間構型__。
(3)用電子式表示下列原子相互結合成的化合物電子式:
①+⑦+⑩:___,
①+⑩形成原子個數比為1:1的化合物:__。
(4)寫出①與⑦所形成僅含離子鍵的化合物和④與⑩所形成的化合物反應的離子方程式:___。
 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
【題目】“中和滴定”原理在實際生產生活中應用廣泛。用I2O5可定量測定CO的含量,該反應原理為5CO+I2O5![]() 5CO2+I2。其實驗步驟如下:
5CO2+I2。其實驗步驟如下:
①取250 mL(標準狀況)含有CO的某氣體樣品通過盛有足量I2O5的干燥管中在170 ℃下充分反應;
②用水一乙醇液充分溶解產物I2,配制100 mL溶液;
③量取步驟②中溶液25.00 mL于錐形瓶中,然后用0.01 mol·L-1的Na2S2O3標準溶液滴定。消耗標準Na2S2O3溶液的體積如表所示。
第一次 | 第二次 | 第三次 | |
滴定前讀數/mL | 2.10 | 2.50 | 1.40 |
滴定后讀數/mL | 22.00 | 22.50 | 21.50 |
(1)步驟②中配制100 mL待測溶液需要用到的玻璃儀器的名稱是燒杯、量筒、玻璃棒、膠頭滴管和____________________。
(2)Na2S2O3標準液應裝在__________(填字母)中。

(3)指示劑應選用__________,判斷達到滴定終點的現象是____________________________________。
(4)氣體樣品中CO的體積分數為__________(已知:氣體樣品中其他成分不與I2O5反應:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作會造成所測CO的體積分數偏大的是__________(填字母)。
a.滴定終點俯視讀數
b.錐形瓶用待測溶液潤洗
c.滴定前有氣泡,滴定后沒有氣泡
d.配制100 mL待測溶液時,有少量濺出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅銅原電池裝置如圖所示,其中陽離子交換膜只允許陽離子和水分子通過,下列有關敘述正確的是

A. 銅電極上發生氧化反應
B. 電池工作一段時間后,甲池的c(SO42-)減小
C. 電池工作一段時間后,乙池溶液的總質量增加
D. 陰陽離子離子分別通過交換膜向負極和正極移動,保持溶液中電荷平衡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值.下列說法正確的是( )
A. 高溫下,0.2 mol Fe與足量水蒸氣反應,生成的H2分子數目為0.3NA
B. 室溫下,1 L pH=13的NaOH溶液中,由水電離的OH﹣離子數目為0.1NA
C. 氫氧燃料電池正極消耗22.4 L(標準狀況)氣體時,電路中通過的電子數目為2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反應中,生成28 g N2時,轉移的電子數目為3.75NA
2HNO3+4N2↑+9H2O反應中,生成28 g N2時,轉移的電子數目為3.75NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 晶體的晶胞結構與
晶體的晶胞結構與![]() 晶體的相似(如下圖所示),但
晶體的相似(如下圖所示),但![]() 晶體中由于啞鈴形
晶體中由于啞鈴形![]() 的存在,使晶胞沿一個方向拉長。則關于
的存在,使晶胞沿一個方向拉長。則關于![]() 晶體的描述不正確的是( )
晶體的描述不正確的是( )
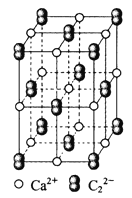
A.![]() 晶體的熔點較高,硬度也較大
晶體的熔點較高,硬度也較大
B.與![]() 距離相同且最近的
距離相同且最近的![]() 構成的多面體是正六面體
構成的多面體是正六面體
C.與![]() 距離相同且最近的
距離相同且最近的![]() 有4個
有4個
D.上圖的結構中共含有4個![]() 和4個
和4個![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E是前36號元素。其中A與B在周期表中位置相鄰,A原子的電子占據2個電子層且原子中成對電子數是未成對電子數的2倍;B的基態原子有7種不同運動狀態的電子;C原子在同周期原子中原子半徑最大(稀有氣體除外);D原子的L電子層中有兩個未成對電子,且無空軌道;E與C位于不同周期,E原子核外最外層電子數與C相同,其余各層電子均充滿。請回答下列問題:(答題時,A、B、C、D、E用所對應的元素符號表示)
(1)A、B、D四種元素第一電離能從小到大順序為_____。
(2)A的穩定氧化物中,中心原子的雜化類型為____,空間構型為_____。
(3)C與電負性最大的元素形成的化合物與B的氫化物熔沸點______更高,原因是_______。
(4)E的某種化合物的結構如圖所示。
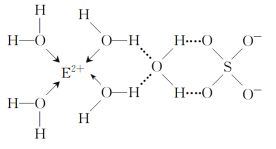
微粒間的相互作用包括化學鍵和分子間相互作用力,此化合物中各種粒子間的相互作用力有____。
A: 離子鍵 B: 共價鍵 C: 配位鍵 D: 氫鍵
(5)元素金(Au)處于周期表中的第六周期,與E同族。一種E合金晶體具有立方最密堆積的結構,在晶胞中E原子處于面心,金原子處于頂點位置,則該合金中E原子與金原子數量之比為____;該晶體中,原子之間的作用力是_____。
(6)上述晶體具有儲氫功能,氫原子可進入到由銅原子與金原子構成的四面體空隙中。若將銅原子與金原子等同看待,該晶體儲氫后的晶胞結構與CaF2的結構相似,該晶體儲氫后的化學式應為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)基態O原子核外電子排布式為_______,基態P原子核外占據最高能級的電子云輪廓圖為_________形;
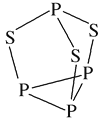
(2)P4S3可用于制造火柴,其分子結構如圖所示。P4S3分子中硫原子的雜化軌道類型為___________,每個P4S3分子中含孤電子對的數目為_______。
(3)Na、O、S簡單離子半徑由大到小的順序為__________
(4)SO2易溶于水,在水中的溶解度為1體積的水溶解40體積的SO2,原因是________。
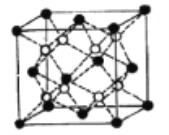
(5)Li2O的晶胞如圖所示(其中白球代表Li,黑球代表O)。已知晶胞參數為0.4665 nm,阿伏加德羅常數的值為NA,則Li2O的密度為______g·cm3(列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t℃時,已知PdI2在水中的沉淀溶解平衡曲線如圖所示,下列說法正確的是( )
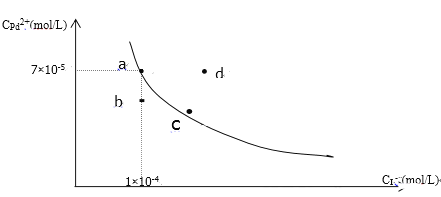
A. 在t℃時PdI2的Ksp=7.0×10-9
B. 圖中a點是飽和溶液,b、d兩點對應的溶液都是不飽和溶液
C. 向a點的溶液中加入少量NaI固體,溶液由a點向c點方向移動
D. 要使d點移動到b點可以降低溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香豆素類化合物常用于治療血栓性疾病,由 4-羥基香豆素(X)和苯代亞芐基丙酮(Y)反應可得到苯代芐丙酮香豆素(Z)。
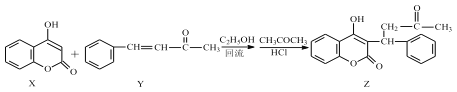
下列說法正確的是
A.X、Y 生成 Z 的反應為加成反應
B.Z 分子中所有碳原子可能共平面
C.1mol 化合物 X 最多能與 1mol NaOH 反應
D.1 mol 化合物 Y 最多能與 5 mol H2 發生加成反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com