
【題目】以高硫鋁土礦(主要成分為Al2O3、Fe2O3,還含有少量FeS2)為原料,生產氧化鋁并獲得Fe3O4的部分工藝流程如圖,下列敘述錯誤的是( )
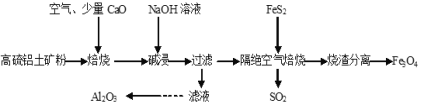
A.燒渣分離可以選擇用磁鐵將燒渣中的Fe3O4分離出來
B.隔絕空氣焙燒時理論上反應消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向濾液中通入過量CO2、過濾、洗滌、灼燒沉淀可制得Al2O3
D.加入CaO可以減少SO2的排放同時生成建筑材料CaSO4
【答案】B
【解析】
由流程可知,高硫鋁土礦(主要成分為Al2O3、Fe2O3,還含有少量FeS2)為原料,通入空氣焙燒時,因為含有少量FeS2,會產生二氧化硫,加入氧化鈣達到吸收二氧化硫的目的,防止二氧化硫排放污染空氣,焙燒產物經過氫氧化鈉溶液堿浸,三氧化二鋁與氫氧化鈉反應生成偏鋁酸鈉,過濾后,濾液中通入過量二氧化碳,偏鋁酸根與二氧化碳、水反應生成氫氧化鋁沉淀,洗滌后灼燒氫氧化鋁即可生產三氧化二鋁;堿浸過程中,三氧化二鐵不與氫氧化鈉反應,過濾后留在濾渣中,加入FeS2與三氧化二鐵在隔絕空氣的條件下反應生成二氧化硫和四氧化三鐵,利用四氧化三鐵的磁性實現其與燒渣的分離。據此分析解答。
A.Fe3O4有磁性,可以用磁鐵將Fe3O4從燒渣中分離出來,故A正確;
B.隔絕空氣焙燒,FeS2與Fe2O3反應,生成SO2和Fe3O4,反應方程式為:FeS2+16Fe2O3 ![]() 11Fe3O4+2SO2↑,由方程式可知n(FeS2)∶n(Fe2O3)=1∶16,故B錯誤;
11Fe3O4+2SO2↑,由方程式可知n(FeS2)∶n(Fe2O3)=1∶16,故B錯誤;
C.濾液中含有AlO2-,通入過量CO2,發生反應:AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3-,生成Al(OH)3沉淀,經過過濾、洗滌后得到Al(OH)3,再灼燒Al(OH)3,反應為:2Al(OH)3 ![]() +3H2O,即可制得Al2O3,故C正確;
+3H2O,即可制得Al2O3,故C正確;
D.鋁土礦中含有FeS2,FeS2焙燒生成SO2,CaO與SO2、O2反應:2CaO+2SO2+O2=2CaSO4,CaSO4可用于建筑材料,故D正確;
故選B。


科目:高中化學 來源: 題型:
【題目】實驗室常用加熱高錳酸鉀的方法制取少量氧氣。
(1)現在欲制取標準狀況下1.12L氧氣,需要消耗高錳酸鉀________g;
(2)反應產生的MnO2經分離出來,與足量濃鹽酸反應,其中被氧化的HCl的物質的量是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列選項中所示的物質轉化過程中未涉及到氧化還原反應的是
A.Fe3O4![]() FeI2
FeI2![]() Fe(OH)2
Fe(OH)2
B.SiO2![]() Si
Si![]() SiCl4
SiCl4
C.NaCl![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
D.SO2![]() H2SO4
H2SO4![]() Na2SO4
Na2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuSO4是一種重要化工原料,其制備和有關性質如圖所示。
(1)現要用如圖所示的濃硫酸來配制步驟①中所需要的1mol/L的稀硫酸480ml,需要用這種濃硫酸的體積為______ml。

(2)配制該稀硫酸所用到的玻璃儀器除玻璃棒、量筒、燒杯外還有_______、__________。
(3)下列操作會使所配溶液濃度偏低的是 _________。
A. 硫酸轉移至容量瓶后,沒有洗滌燒杯
B. 未冷卻至室溫就轉移至容量瓶
C. 容量瓶中存在少量蒸餾水
D. 定容時俯視刻度 E.量取濃硫酸時量筒內有少量蒸餾水
(4)制取硫酸銅的途徑①②③中,途徑_________能更好地體現綠色化學的思想。
(5)配制1000ml 0.1mol/L的硫酸銅溶液,需用托盤天平稱取________g膽礬。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列方法均可制得氯氣:
①MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(濃)===KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(濃)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同質量的氯氣,①②③反應中電子轉移數目之比為( )
A. 6∶5∶6B. 1∶3∶5C. 15∶5∶3D. 1∶6∶10
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)取300mL 0.2mol/L的KI溶液與一定量的酸性KMnO4溶液恰好反應,生成等物質的量的I2和KIO3,則消耗KMnO4的物質的量的是______mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黃色變為淺綠色,過一會又變為棕黃色,溶液先變為淺綠色的離子方程式是________,又變為棕黃色的原因是用離子方程式解釋___________________________.
(3)在100mLFeBr2溶液中通入標況下2.24LCl2,溶液溶液中有1/4的Br- 被氧化成單質Br2,則原FeBr2溶液中FeBr2的物質的量濃度為_________________。
(4)將Al、Al2O3和Al(OH)3的混合物恰好與NaOH溶液反應,反應后溶液中溶質的化學式_________。向反應后的溶液中通入過量CO2,反應的離子方程式為______。
(5)三氟化氮(NF3)是一種無色,無味的氣體,它是微電子工業技術的關鍵原料之一,三氟化氮在潮濕的空氣中與水蒸氣能發生氧化還原反應,其反應的產物有:HF、NO和HNO3,請根據要求回答下列問題:
①寫出該反應的化學方程式___________,反應中生成0.2mol HNO3,轉移的電子數目為_______。
②NF3無色、無臭,但一旦在空氣中泄漏,還是易于發現,判斷該氣體泄漏時的現象是________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關蘋果酸(![]() )的說法正確的是
)的說法正確的是
A. 1mol蘋果酸與足量金屬Na反應生成1molH2
B. 蘋果酸可發生酯化反應,消去反應,縮聚反應
C. 蘋果酸能與H2發生加成反應
D. 1mol蘋果酸可與3molNaOH發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1.92gFe和Fe2O3的混合物溶于200mL鹽酸中,生成0.336L(標準狀況下)氫氣,向反應后的溶液中加入KSCN檢驗,溶液不顯紅色。為讓溶液中的金屬離子恰好完全沉淀,消耗了400mL0.750 mol/L的氫氧化鈉溶液。則:
(1)產生的氫氣中所含的分子數為___。
(2)混合物中Fe和Fe2O3的物質的量之比為___。
(3)鹽酸的物質的量濃度為___mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】食品香精菠蘿酯的生產路線(反應條件略去)如下

下列敘述錯誤的是()
A. 步驟(1)產物中殘留的苯酚可用FeCl3溶液檢驗
B. 苯酚和菠蘿酯均可與酸性KMnO4溶液發生反應
C. 步驟(2)產物中殘留的烯丙醇可用溴水檢驗
D. 苯氧乙酸和菠蘿酯均可與NaOH溶液發生反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com