
【題目】甲、乙兩位同學分別按圖1所示裝置進行實驗,甲同學在虛線框內接一個電流計,乙同學在虛線框內沒有做連接,請回答下列問題:
(1)以下敘述正確的是______
A.甲同學實驗中,石墨棒上無氣泡產生
B.甲、乙兩同學實驗中的鐵片都是負極
C.甲同學實驗中,電子在溶液中沒有遷移
D.甲、乙同學在實驗中都發現有氣泡生成,產生氣泡的速率甲比乙慢
(2)甲同學觀察到電流計指針發生偏轉,根據實驗中的發現,繪制了圖2,X軸表示實驗時流入正極的電子的物質的量,則Y軸可能表示______
A.石墨棒的質量B.鐵棒的質量C.c(H+)D.c(SO42-)E.c(Fe2+)
(3)采用甲同學裝置,實驗時把稀硫酸換成硫酸銅溶液,請寫出鐵電極電極反應式:______,石墨電極觀察到的現象______,發生了______反應(填“氧化”、“還原”或“非氧化還原”)。

【答案】C BC Fe-2e-=Fe2+ 石墨電極上有紅色物質析出 還原
【解析】
(1)A.甲同學實驗中,構成鐵碳原電池,鐵為原電池的負極,石墨棒為正極,氫離子得到電子生成氫氣,故A錯誤;
B.甲同學實驗中,構成了原電池,鐵為原電池的負極,石墨為原電池的正極,乙同學實驗中在虛線框內沒有做連接,不構成原電池,鐵片與稀硫酸發生化學反應,故B錯誤;
C.甲同學實驗中,構成了原電池,電子在導線上運動,從鐵到碳,溶液中沒有遷移,故C正確;
D.甲同學實驗中,構成了原電池,屬于鐵的電化學腐蝕,乙同學實驗中在虛線框內沒有做連接,不構成原電池,鐵片與稀硫酸反應,屬于化學腐蝕,電化學腐蝕速率大于化學腐蝕的速率,所以甲中產生氫氣的速率比乙快,故D錯誤;
所以本題答案為:C;
(2)鐵碳原電池中,鐵是負極,失去電子發生氧化反應,電極反應為Fe-2e-=Fe2+,碳是正極,氫離子得電子發生還原反應,電極反應為2H++2e-=H2↑。
A.石墨棒是正極,氫離子得電子發生還原反應,石墨棒的質量不變,故A錯誤;
B.由于鐵是負極,不斷發生反應Fe-2e-=Fe2+,所以鐵棒的質量減小,故B正確;
C.由于反應不斷消耗H+產生氫氣,所以溶液的c(H+)逐漸降低,故C正確;
D.SO42-不參加反應,其濃度不變,故D錯誤;
E.由于鐵是負極,不斷發生反應Fe-2e-=Fe2+,所以溶液中c(Fe2+)增大,故E錯誤;
所以本題答案為:BC;
(3)如果把硫酸換成硫酸銅溶液,則電池總反應為鐵與銅離子的反應,負極鐵失去電子,電極反應為Fe-2e-=Fe2+,正極石墨上銅離子得到電子生成銅,Cu2++2e-=Cu,石墨電極上有紅色物質析出,發生還原反應,故答案為:Fe-2e-=Fe2+;石墨電極上有紅色物質析出;還原。


科目:高中化學 來源: 題型:
【題目】常溫下,將0.1 mol/LNaOH溶液分別滴加到0.1 mol/LHA溶液和HB溶液中,兩混合溶液中離子濃度與pH的變化關系如圖所示,回答下列問題:

(1)請計算出Ka(HA) =_____,Ka(HB)_____ Ka(HA) (填“大于' “等于”或“小于”)。
(2)等濃度的HA和HB溶液,若要向其中之一加水讓二者pH值相等,應該向_____中加水。
(3)若分別向等濃度等體積的HA和HB溶液中加入NaOH固體讓二溶液都呈中性,則 ______需要的NaOH多。
(4)a點溶液中,水電離出的c(H+)=_______。b點溶液中,c(B-)____ c(Na+)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在2 L的密閉容器中,X、Y、Z三種物質的量隨時間的變化曲線如圖所示。

(1)當反應進行到第_______min,該反應達到平衡。
(2)計算X的轉化率______。
(3)計算反應從開始至2分鐘末,Z物質的化學反應速率______。
(4)由圖中所給數據進行分析,該反應的化學方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用100mLNaOH溶液捕獲CO2,一定時間后,測定CO2的吸收量。充分反應后,再向所得溶液中逐滴加入2.0mol/L的鹽酸,產生CO2的體積與所加鹽酸體積之間關系如圖所示。回答下列問題:

(1)原NaOH溶液的物質的量濃度為______;
(2)題中通入CO2后所得溶液中的溶質有______,溶液中溶質的物質的量之比為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(I)50 mL 0.50 mol/L鹽酸與50 mL 0.55 mol/L NaOH溶液在如圖所示的裝置中進行中和反 應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:

(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品是________;
(2)用相同濃度和體積的醋酸代替稀鹽酸溶液進行實驗,求得的中和熱數值________(填“偏 大”、“偏小”或“無影響”);
(3)實驗中改用60 mL 0.50 mol/L 鹽酸跟50 mL 0.55 mol/L NaOH溶液進行反應,與上述實驗相比,所放出的熱量________(填“相等”或“不相等”),所求中和熱________(填“相等”或“不相等”),簡述理由________________________________________________________。
(Ⅱ).某探究小組用HNO3與大理石反應過程中質量減小的方法,研究影響反應速率的因素。所用HNO3濃度為1.00 mol/L、2.00 mol/L,大理石有細顆粒和粗顆粒兩種規格,實驗溫度為25℃、35℃,每次實驗HNO3的用量為25.00 mL,大理石用量為10.00 g。
(4)請完成以下實驗設計表,并在實驗目的一欄中填空:
實驗編號 | 溫度(℃) | 大理石規格 | HNO3濃度(mol/L) | 實驗目的 |
① | 25 | 粗顆粒 | 2.00 | (Ⅰ)實驗①和②探究濃度對反應速率的影響;(Ⅱ)實驗①和③探究溫度對反應速率的影響;(Ⅲ)實驗①和④探究e_______對反應速率的影響 |
② | 25 | 粗顆粒 | a______ | |
③ | b_______ | 粗顆粒 | 2.00 | |
④ | c________ | 細顆粒 | d______ |
(5)實驗①中CO2質量隨時間變化的關系見下圖。計算實驗①中70 s~90 s范圍內用HNO3表示的平均反應速率________(忽略溶液體積變化,不需要寫出計算過程)。在O~70、70~90、90~200各相同的時間段里,反應速率最大的時間段是________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示三套實驗裝置,分別回答下列問題。
圖1
圖2
圖3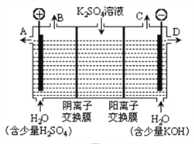
(1)圖1中,① 若開始時開關K與a連接,則該裝置為_____(填裝置名稱),電極A的電極反應式為________________________
②若開始時開關K與b連接,則總反應的離子方程式為___________________
(2)2004年美國圣路易斯大學研制了一種新型的乙醇電池,它用磺酸類質子溶劑,在200°C左右時供電,電池示意如圖2所示:
①______極(填a或b)為電池的正極,電池工作時電子的流向為_________(填a→b或b→a)
②寫出該電池負極的電極反應式________________________________________
(3)用圖3裝置電解硫酸鉀溶液來制取氫氣、氧氣、硫酸和氫氧化鉀(電解槽內的陽離子交換膜只允許陽離子通過,陰離子交換膜只允許陰離子通過)。
①該電解槽的陰極反應式為_____________________。
②制得的硫酸溶液從出口__________________________(填“A”、“D”)導出,并簡述原因__________________________(請用化學用語和文字解釋)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為確定碳酸鈉和碳酸氫鈉混合樣品中碳酸鈉的質量分數,可通過加熱分解得到的CO2質量進行計算,某同學設計的實驗裝置示意圖如下:

請回答:
(1)儀器a的名稱是_____________。
(2)裝置B中冰水的作用是_________。
(3)該同學設計的實驗裝置存在缺陷,有關該實驗裝置及實驗過程中,下列因素可能使碳酸鈉的質量分數偏高的是______。
A.樣品分解不完全
B.裝置B、C之間缺少CO2的干燥裝置
C.產生CO2氣體的速率太快,沒有被堿石灰完全吸收
D.反應完全后停止加熱,通入過量的空氣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com