
【題目】以反應5H2C2O4+2MnO4-+6H+===10CO2↑+2Mn2++8H2O為例探究“外界條件對化學反應速率的影響”。實驗時,分別量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并開始計時,通過測定溶液褪色所需時間來判斷反應的快慢。
編號 | H2C2O4溶液 | 酸性KMnO4溶液 | 溫度/℃ | ||
濃度/mol·L-1 | 體積/mL | 濃度/mol·L-1 | 體積/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列說法不正確的是
A. 實驗①、②、③所加的H2C2O4溶液均要過量
B. 實驗①測得KMnO4溶液的褪色時間為40 s,則這段時間內平均反應速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
C. 若生成a L CO2(標準狀況),該反應轉移的電子數為aNA/22.4
D. 實驗①和②起初反應均很慢,過了一會兒速率突然增大,可能是生成的Mn2+對反應起催化作用
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】把NaOH、MgCl2、AlCl3三種固體組成的混合物溶于足量水后有1.16g白色沉淀,在所得的濁液中逐滴加入1molL﹣1 HCl溶液,加入HCl溶液的體積與生成沉淀的質量關系如圖所示,試回答:
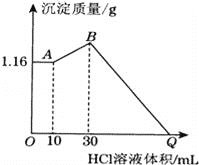
(1)寫出混合物溶于水時發生反應的離子方程式________________________________________________。
(2)寫出AB段反應的離子方程式__________________。B點的沉淀物的化學式為______________。
(3)求原混合物中AlCl3的物質的量____________,NaOH的質量________________。
(4)求Q點加入的HCl溶液體積.______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】植物油和水、酒精和水、碘的飽和水溶液,這三組混合物的分離方法分別是( )
A. 過濾、蒸餾、分液 B. 分液、蒸餾、萃取
C. 萃取、蒸餾、過濾 D. 萃取、過濾、蒸餾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產、生活密切相關,下列說法正確的是( )
A.明礬凈水時發生了化學及物理變化,能起到殺菌、消毒的作用
B.淀粉溶液、豆漿、霧、碳素墨水均可發生丁達爾現象
C.合金、光導纖維、碳纖維、玻璃鋼都屬于復合材料
D.光化學煙霧、臭氧層空洞、溫室效應、酸雨(硝酸型)的形成都與氮氧化物有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣、鋁、鐵都是重要的還原劑,已知下列反應的熱化學方程式,下列關于反應的焓變判斷正確的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學式為AB的離子晶體,已知5r(A2+)=4r(B2-)(各類離子晶體與![]() 關系如下圖所示),經測定其密度為
關系如下圖所示),經測定其密度為![]() g·cm-3,其摩爾質量為Mg·mol-1,則下列有關該晶體的說法正確的是( )
g·cm-3,其摩爾質量為Mg·mol-1,則下列有關該晶體的說法正確的是( )
r+/r- | 配位數 | 實例 |
0.225~0.414 | 4 | ZnS |
0.414~0.732 | 6 | NaCl |
0.732~1.0 | 8 | CsCl |
>1.0 | 12 | CsF |
A.該晶體結構與ZnS晶體相似
B.該晶體每個晶胞中有2個A2+和B2-
C.該晶體晶胞的邊長為 cm
cm
D.A2+離子緊鄰的B2-構成的空間結構為立方體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源是人類社會不斷發展的核心驅動力。下列說法正確的是
A.D、T核聚變發電過程中不產生新元素
B.光催化CO2和H2O合成甲醇為放熱反應
C.可燃冰是天然氣水合物,屬于清潔能源
D.流水、地熱能發電的能量轉化形式相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳是形成化合物種類最多的元素,其單質及化合物是人類生產生活的主要能源物質。請回答下列問題:
(1)有機物M經過太陽光光照可轉化成N,轉化過程如下:
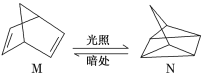
ΔH=+88.6 kJ/mol則M、N相比,較穩定的是________。
(2)已知CH3OH(l)的燃燒熱ΔH=-238.6 kJ/mol,CH3OH(l)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-a kJ/mol,則a________238.6(填“>”、“<”或“=”)。
O2(g)===CO2(g)+2H2(g) ΔH=-a kJ/mol,則a________238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通過灼熱的炭層,生成HCl和CO2,當有1 mol Cl2參與反應時釋放出145 kJ熱量,寫出該反應的熱化學方程式:____________________。
(4)火箭和導彈表面的薄層是耐高溫物質。將石墨、鋁粉和二氧化鈦按一定比例混合在高溫下煅燒,所得物質可作耐高溫材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ/mol,則反應過程中,每轉移1 mol電子放出的熱量為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com