解:
(1)根據質量守恒定律及圖示可知:反應過程中產生的氣體質量為:58-54.7=3.3g;故答案為:3.3g;
(2)據題知碳酸鈣樣品的質量是8g.
設樣品中碳酸鈣的質量為X
CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O
100 44
X 3.3g

═
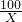
解得x=7.5g
樣品中碳酸鈣的質量分數:
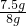
×100%=93.75%
答:樣品中碳酸鈣的質量分數是93.75%
(3)根據消耗固體樣品質量與生成氣體質量變化關系畫圖:

(4)樣品中鈣元素的質量分數=

=37.5%<40%
因為 37.5%<40%
通過計算可知標簽標示的含鈣量,不正確;
故答案為:不正確.
分析:(1)根據質量守恒定律及圖示,進行解答;
(2)根據燒杯中加入50g的鹽酸,58g為反應開始時燒杯中物質的質量,進行分析碳酸鈣的質量;
(3)根據消耗固體樣品質量與生成氣體質量變化關系畫圖;
(4)根據質量發生的比較,即可解得.
點評:解讀折線是初中化學計算中的一種常規題型,解題時首先明確發生的化學反應,再看曲線的三點:起點、折點和終點,獲得并處理信息,找到解題突破口,解答試題.


 ═
═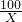
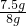 ×100%=93.75%
×100%=93.75%
 =37.5%<40%
=37.5%<40%

 某興趣小組購得用于食用菌種植的輕質碳酸鈣(雜質中不含鈣元素),標簽如圖.為了測定其含鈣量,該小組采用如圖裝置進行實驗,實驗步驟如下:
某興趣小組購得用于食用菌種植的輕質碳酸鈣(雜質中不含鈣元素),標簽如圖.為了測定其含鈣量,該小組采用如圖裝置進行實驗,實驗步驟如下: