
【題目】(1)氨氣可作為脫硝劑,在恒溫恒容密閉容器中充入一定量的NO和NH3,在一定條件下發(fā)生反應:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能說明該反應已達到平衡狀態(tài)的標志是____________
a.反應速率 v( NH3) =v( N2) b.容器內壓強不再隨時間而發(fā)生變化 c.容器內 N2 的物質的量分數不再隨時間而發(fā)生變化 d.容器內 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 鍵斷裂的同時生成 5mol N≡N 鍵 f.混合氣體的總質量不隨時間的變化而變化
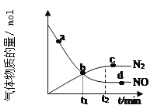
②某次實驗中測得容器內 NO及N2的物質的量隨時間變化如圖所示,圖中b點對應的速率關系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 點對應的速率關系是v(正) ___________ v(逆) (填﹥、﹤或﹦)。
(2) 已知:N≡N的鍵能為946kJ/mol, H-H的鍵能為436kJ/mol,N-H的鍵能為391kJ/mol,則N2與H2反應,生成1mol NH3過程中______(填“吸收”或“放出”)的能量為_______kJ。
(3) 一定條件下,在 5 L密閉容器內,反應 2NO2(g) ![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)隨時間變化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)隨時間變化如下表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用 N2O4 表示 0~2 s 內該反應的平均速率為________ molL-1s-1。在第 5s 時,NO2 的轉化率為___________。
②根據上表可以看出,隨著反應進行,反應速率逐漸減小,其原因是______________。
③為加快反應速率,可以采取的措施是_______
a.升高溫度 b.恒容時充入He氣 c.恒壓時充入He氣 d.恒容時充入NO2
【答案】bc > = 放出 46 0.0015 87.5% 隨著反應的進行,NO2濃度減小,反應速率減小 ad
【解析】
(1)①可逆反應達到平衡時,同物質的正逆反應速率相等,各組分的濃度,含量保持不變,由此衍生出其他的一些量不變,判斷平衡的物理量應隨反應進行發(fā)生變化,該物理量由變化到不再變化說明達到平衡;
②可逆反應正向進行時v正>v逆,平衡時v正=v逆;
(2)焓變=反應物總鍵能-生成物總鍵能;
(3)②降低溫度、濃度減小等因素可以使反應速率降低;
③升高溫度、增大濃度、縮小體積增大壓強、加入催化劑可以增大反應速率。
(1)①a.反應速率之比等于計量數之比,該反應達到平衡狀態(tài)時,5v正(NH3)=4v逆(N2),故a錯誤;
b.該反應是一個反應前后氣體體積增大的可逆反應,當反應達到平衡狀態(tài)時,容器內壓強不隨時間的變化而變化,所以能判斷反應是否達到平衡狀態(tài),故b正確;
c.容器內N2的物質的量分數不再隨時間而發(fā)生變化說明濃度不在改變,反應達到平衡狀態(tài),故c正確;
d.物質的量之比等于計量數之比不能說明正逆反應速率相等或者濃度不變,故d錯誤;
e.12molN-H 鍵斷裂的同時生成5molN≡N鍵均表示正反應速率,故e錯誤;
f.反應物和生成物均為氣體,所以混合氣體的總質量不變?yōu)槎ㄖ担?/span>f錯誤;
故答案為:bc;
②圖中b點未平衡,NO的物質的量還在減少,所以圖中b點對應的速率關系是v(正)>v(逆); d點NO的物質的量不再改變,反應達到平衡時ν(正)=ν(逆);
(2)N2與H2反應,生成1mol NH3熱化學方程式為![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)△H,該反應△H=
H2(g)NH3(g)△H,該反應△H=![]() ×946kJ/mol+
×946kJ/mol+![]() ×436kJ/mol-3×391kJ/mol=-46 kJ/mol,焓變小于0為放熱反應,所以生成1mol NH3的過程中方程46kJ能量;
×436kJ/mol-3×391kJ/mol=-46 kJ/mol,焓變小于0為放熱反應,所以生成1mol NH3的過程中方程46kJ能量;
(3)①0~2s內△n(NO2)=0.040mol-0.010mol=0.030mol,根據反應方程式可知該時段內△n(N2O4)=0.015mol,容器體積為5L,所以v(N2O4)=![]() =0.0015 molL-1s-1;第5s時△n(NO2)=0.040mol-0.005mol=0.035mol,所以NO2的轉化率為
=0.0015 molL-1s-1;第5s時△n(NO2)=0.040mol-0.005mol=0.035mol,所以NO2的轉化率為![]() =87.5%;
=87.5%;
②該反應正反應為放熱反應,反應進行溫度升高,所以溫度對速率的影響是增大,則應考慮濃度對反應速率的影響,隨著反應的進行,NO2濃度減小,反應速率減小;
③a.升高溫度可以增大活化分子百分數,增大反應速率,故a符合題意;
b.恒容時充入He氣,反應物和生成物的濃度不變,不影響反應速率,故b不符合題意;
c.恒壓時充入He氣,容器體積增大,反應物和生成物濃度減小,反應速率減慢,故c不符合題意;
d.恒容充入NO2,反應物濃度增大,反應速率加快,故d符合題意;
綜上所述選ad。


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是
A.0.1molNa2O2所含的離子總數是0.4NA
B.0.1mol的11B中,含有0.6NA個中子
C.常溫常壓下,124gP4中所含P—P鍵數目為4NA
D.密閉容器中,2molSO2和1molO2催化反應后分子總數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硅及其化合物在生產生活中具有廣泛的用途。
(1)工業(yè)生產粗硅的化學反應方程式為:SiO2+2C![]() Si(粗硅)+2CO↑。該反應中,被還原的元素是___,還原劑是___(填化學式),若轉移1mol電子則生成的CO在標準狀況下的體積為___L。
Si(粗硅)+2CO↑。該反應中,被還原的元素是___,還原劑是___(填化學式),若轉移1mol電子則生成的CO在標準狀況下的體積為___L。
(2)由粗硅制純硅的過程為:
Ⅰ.粗硅與氯氣反應生成四氯化硅(SiCl4);
Ⅱ.在高溫下用氫氣還原四氯化硅得到純硅。Ⅱ所發(fā)生反應的化學方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】微生物燃料電池是指在微生物的作用下將化學能轉化為電能的裝置,某微生物燃料電池的工作原理如圖所示,下列說法錯誤的是

A.b電極發(fā)生還原反應:4H++O2+4e-=2H2O
B.電路中有4mol電子發(fā)生轉移,大約消耗標準狀況下22.4L空氣
C.維持兩種細菌存在,該裝置才能持續(xù)將有機物氧化成CO2并產生電子
D.HS-在硫氧化菌作用下轉化為![]() 的反應是
的反應是![]() =
=![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,體積一定的密閉容器中進行如下可逆反應:X(g)+Y(g) ![]() Z(g)+W(s);△H >0
Z(g)+W(s);△H >0
下列敘述正確的是
A. 減少少量W,逆反應速率減小
B. 當容器中氣體的平均摩爾質量不變時,反應達到平衡
C. 降低溫度,平衡正向移動
D. 平衡后加入Z,上述反應的△H減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2O和CO是環(huán)境污染性氣體,可在Pt2O+ 表面轉化為無害氣體,其反應原理為N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有關化學反應的物質變化過程及能量變化過程如下。下列說法不正確的是
CO2(g) + N2(g) ΔH,有關化學反應的物質變化過程及能量變化過程如下。下列說法不正確的是
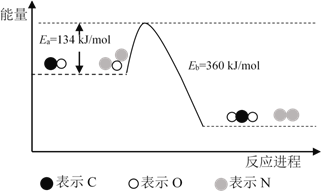
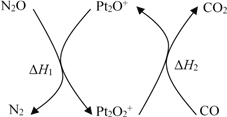
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 該反應正反應的活化能小于逆反應的活化能
D. 為了實現轉化需不斷向反應器中補充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿伏加德羅常數的值為NA。下列說法不正確的是
A.常溫常壓下,2 g D2O 中含中子數為NA
B.1mol苯乙烯(![]() )分子中含有碳碳雙鍵的個數為4 NA
)分子中含有碳碳雙鍵的個數為4 NA
C.0.5mol羥基中所含電子數為4.5NA
D.28g乙烯和丙烯(C3H6)的混合氣體含有的碳原子數目為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用Pt-g-C3N4光催化氧化法脫除NO的過程如圖所示。該脫除過程中,下列說法不正確的是

A.該脫除過程中太陽能轉化為化學能。
B.在Pt端發(fā)生的是氧化反應
C.過程①發(fā)生的反應為H2O2 - 2e-=O2↑+ 2H+
D.過程③的化學方程式2NO2 + H2O2= 2HNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備1,2—二溴乙烷的反應原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反應有:乙醇在濃硫酸的存在下在140℃脫水生成乙醚。
用少量溴和足量的乙醇制備1,2—二溴乙烷的裝置如圖所示:

有關數據列表如下:

回答下列問題:
(1)在此制備實驗中,要盡可能迅速地把反應溫度提高到170℃左右,其最主要目的是________;(填正確選項前的字母)
a. 引發(fā)反應 b. 加快反應速度
c. 防止乙醇揮發(fā) d. 減少副產物乙醚生成
(2)在裝置C中應加入________,其目的是吸收反應中可能生成的酸性氣體;(填正確選項前的字母)
a 水 b 濃硫酸 c 氫氧化鈉溶液 d 飽和碳酸氫鈉溶液
(3)判斷該制備反應已經結束的方法是D裝置中____________________________;
(4)將1,2—二溴乙烷粗產品置于分液漏斗中加水,振蕩后靜置,溶液分層,產物應在______層(填“上”“下”);分離該有機物的方法叫_______________。
(5)若產物中有少量乙醚生成,最好用__________除去;(填正確選項前的字母)
a蒸發(fā) b 蒸餾 c 重結晶
(6)反應過程中應用冷水冷卻裝置D,其主要目的是____________________。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com