
【題目】【化學—選修:物質結構與性質】
金屬鈦(22Ti)號稱航空材料。回答下列問題:
(1)鈦元素基態原子未成對電子數為________個,能量最高的電子占據的能級符號為___________,該能級所在能層具有的原子軌道數為_____________。
(2)[Ti(OH)2(H2O)4]2+中的化學鍵有_____________。
a.σ鍵 b.π鍵 c.離子鍵 d.配位鍵
(3)納米TiO2是一種應用廣泛的催化劑,納米TiO2催化的一個實例如圖所示。

化合物甲的分子中采取sp2雜化方式的碳原子個數為__________,化合物乙中采取sp3雜化的原子的第一電離能由小到大的順序為____________。
(4)工業上制金屬鈦采用金屬還原四氯化鈦。先將TiO2(或天然的金紅石)和足量炭粉混合加熱至1000~1100K,進行氯化處理,生成TiCl4.寫出生成TiCl4的化學反應方程式:_______________。
(5)有一種氮化鈦晶體的晶胞如圖所示,該晶體的化學式為____________,該晶體中Ti原子周圍與距離最近且相等的 N原子的個數為___________。已知晶體的密度為ρg·cm-3,阿伏加德羅常數為NA,則晶胞邊長為________cm(用含ρ、NA的式子表示)。

【答案】23d9ad7C<O<NTiO2+ 2C+2C12 ![]() TiCCl4+2COTiN4
TiCCl4+2COTiN4![]()
【解析】(1)Ti元素價電子排布式為3d24s2,基態原子價電子排布圖為![]() ,可見鈦元素基態原子未成對電子數為2個,能量最高的電子占據的能級符號為3d,該能級所在能層為M能層,有3s、3p、3d,分別含有原子軌道數目為1、3、5,具有的原子軌道數為9;
,可見鈦元素基態原子未成對電子數為2個,能量最高的電子占據的能級符號為3d,該能級所在能層為M能層,有3s、3p、3d,分別含有原子軌道數目為1、3、5,具有的原子軌道數為9;
(2)[Ti(OH)2(H2O)4]2+中的化學鍵只有σ鍵和配位鍵,即答案為ad;
(3)采取sp2雜化的碳原子價層電子對數是3,該分子中碳原子價層電子對數為3的有:苯環上的碳原子、連接羰基的碳原子,所以一共有7個;采取sp3雜化的原子價層電子對數是4,價層電子對個數是4的原子有:連接甲基和羥基的碳原子、氧原子和氮原子,同一周期元素中,元素的第一電離能隨著原子序數的增大而呈增大趨勢,但第VA族元素大于相鄰元素,所以這三種元素第一電離能從小到大順序是:C<O<N;
(4)TiO2和足量炭粉混合加熱至1000~1100K,生成TiCl4的化學反應方程式為2C+2C12 ![]() TiCCl4+2CO;
TiCCl4+2CO;
(5)觀察晶胞N位于立方體的頂點和面心位置,N數=8×![]() +6×
+6×![]() =4;Ti位于晶胞內,有4個,化學式可寫為TiN;由晶胞圖可知與Ti相連的N有四個,組成正四面體;晶胞質量為4×
=4;Ti位于晶胞內,有4個,化學式可寫為TiN;由晶胞圖可知與Ti相連的N有四個,組成正四面體;晶胞質量為4×![]() g,晶體的密度為ρ gcm-3,則晶胞邊長為
g,晶體的密度為ρ gcm-3,則晶胞邊長為![]() =
=![]() cm。
cm。


科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.金屬氧化物一定是堿性氧化物 B.堿性氧化物一定是金屬氧化物
C.非金屬氧化物一定是酸性氧化物 D.酸性氧化物一定是非金屬氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右表是元素周期表的一部分,其中A、B、D、E、G、J為短周期元素,G元素的核電荷數為B元素的2倍。請回答下列問題:
A | B | ||
D | E | G | J |
L | M | Q |
(1)J的最高價氧化物對應水化物的化學式是___________________。
(2)G2J2常用作橡膠的低溫硫化劑和黏結劑,其電子式為_______________________。寫出一個能表示元素G、J非金屬性強弱關系的化學方程式____________________________。
(3)G單質在空氣中燃燒生成一種無色有刺激性氣味的氣體,該無色有刺激性氣味的氣體與含1molJ的一種含氧酸(該酸的某鹽常用于實驗室制取氧氣)的溶液在—定條件下反應,可生成一種強酸和一種氧化物,且該反應中有NA個電子轉移,則該反應的化學方程式是________________________。
(4)A的最簡單氫化物是___________(填“極性”或“非極性”)分子,實驗室制備該物質的化學方程式為__________________________________________。
(5)根據元素周期律,可以推測上表中長周期元素的單質具有半導體特性的是__________(填元素符號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,S8(s)和O2(g)發生反應依次轉化為SO2(g)和SO3(g)(已知:2SO2+O2![]() 2SO3),反應過程中的能量關系可用右圖簡單表示(圖中的ΔH 表示生成1 mol產物的數據)。 下列說法正確的是( )
2SO3),反應過程中的能量關系可用右圖簡單表示(圖中的ΔH 表示生成1 mol產物的數據)。 下列說法正確的是( )
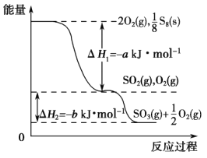
A.S8的燃燒熱 ΔH=-a kJ·mol-1
B.1 mol SO2和過量 O2反應可釋放出 b kJ 的熱量
C.已知1個S8分子中有8個S-S,S=O的鍵能為d kJ·mol-1,O=O的鍵能為e kJ·mol-1,則S8分子中S-S的鍵能為(2d-a-e) kJ·mol-1
D.若使用V2O5作催化劑,當SO2(g)轉化生成1mol SO3(g)時,釋放的熱量小于b kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把等物質的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,經充分攪拌后,將
所得溶液用石墨電極進行電解,陽極生成的物質是( )
A. H2 B. Ag C. Cl2 D. O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某原電池總反應的離子方程式是Fe+2Fe3+=3Fe2+ , 該原電池的組成正確的是( )
Zn | A | B | C | D |
正極 | Fe | C(石墨) | Ag | Zn |
負極 | Cu | Fe | Fe | Fe |
電解質溶液 | FeCl3 | Fe2 (SO4)3 | H2SO4 | FeCl3 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將32.64g銅與140mL一定濃度的硝酸反應,銅完全溶解產生的NO和NO2混合氣體在標準狀況下的體積為11.2L。請回答:
(1)NO的體積為_____L,NO2的體積為______L。
(2)參加反應的硝酸的物質的量是_______mol。
(3)待產生的氣體全部釋放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為___________mol/L。(結果不需化簡)
(4)欲使銅與硝酸反應生成的氣體在NaOH溶液中全部轉化為NaNO3,至少需要30%的雙氧水________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】課外學習小組為檢驗溶液中是否含有常見的四種無機離子,進行了如圖所示的實驗操作。其中操作過程中產生的氣體能使紅色石蕊試紙變藍,由該實驗能得到的正確結論是( )
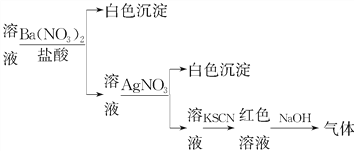
A. 溶液中一定含有SO![]()
B. 溶液中一定含有NH![]()
C. 溶液中一定含有Cl-
D. 溶液中一定含有Fe3+
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com