KClO3和濃鹽酸在一定溫度下反應會生成黃綠色的易爆物二氧化氯.其變化可表述為:□KClO3+□HCl(濃)-□KCl+□Cl2↑+□ClO2↑+□______
(1)配平化學方程式并標出電子轉移的方向和數目(未知物化學式和系數填入框內)
(2)濃鹽酸在反應中顯示出來的性質是______(填寫編號,多選倒扣).
①只有還原性 ②還原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)產生0.1mol Cl2,則轉移的電子的物質的量為______.
(4)ClO2具有很強的氧化性.因此,常被用作消毒劑,其消毒的效率(以單位物質的量得到的電子數表示)是Cl2的______倍.
解:(1)KClO
3中氯元素化合價由+5價降低為ClO
2中+4價,化合價降低1價;HCl中氯元素化合價由-1價升高為Cl
2中0價,化合價升高2價,化合價升降最小公倍數為2,故ClO
2系數為2,Cl
2系數為1;所以KClO
3系數為2,KCl系數為2,HCl系數為4,結合元素守恒,可知未知物是水,水的系數是2.電子轉移的方向和數目為:
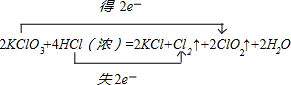
故答案為:2、4、2、1、2、2H
2O;
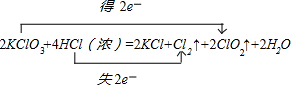
.
(2)反應2KClO
3+4HCl(濃)=2KCl+Cl
2↑+2ClO
2↑+2H
2O中,HCl中氯元素化合價由-1價升高為Cl
2中0價可知,HCl中氯元素被氧化,HCl在反應中還原劑與酸的作用,各中一半.
故選:②.
(3)反應中只有Cl
2是氧化產物,HCl中氯元素化合價由-1價升高為Cl
2中0價,所以產生0.1molCl
2,轉移的電子的物質的量為0.1mol×2=0.2mol.
故答案為:0.2mol.
(4)1molCl
2可以獲得2mol電子,1molClO
2可以獲得電子5mol電子.ClO
2消毒的效率是Cl
2的
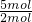
=2.5倍.
故答案為:2.5.
分析:(1)KClO
3中氯元素化合價由+5價降低為ClO
2中+4價,化合價降低1價;HCl中氯元素化合價由-1價升高為Cl
2中0價,化合價升高2價,化合價升降最小公倍數為2,故ClO
2系數為2,Cl
2系數為1;再結合元素守恒,可知未知物是水,配平各物質的系數.
(2)根據HCl中氯元素化合價由-1價升高為Cl
2中0價可知,HCl中氯元素被氧化,HCl在反應中還原劑與酸的作用,各中一半.
(3)反應中只有Cl
2是氧化產物,HCl中氯元素化合價由-1價升高為Cl
2中0價,據此計算轉移電子物質的量.
(4)1molCl
2可以獲得2mol電子,1molClO
2可以獲得電子5mol電子.
點評:考查氧化還原反應基本概念、配平、計算等,難度中等,判斷氧化產物、還原產物是關鍵,注意同種元素反應氧化還原反應價態歸中不交叉原則.

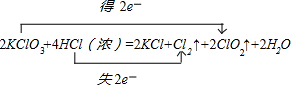 .
.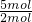 =2.5倍.
=2.5倍.

 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案
