
【題目】下列屬于氧化還原反應的是( )
A.NH4Cl+NaOH ![]() NH3↑+NaCl+H2O
NH3↑+NaCl+H2O
B.MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Na2O2+2H2O=2NaOH+H2O2
D.SO2+H2O=H2SO3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】研究表明許多疾病,包括基因突變(癌變、動脈硬化等)和生物機體中毒等,可能是一氧化氮的釋放或調節不正常引起的。用間接電化學法可對NO進行無害化處理,其原理如圖所示(質子膜允許H+和H2O通過),下列相關判斷不正確的是 ( )
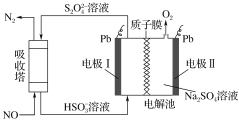
A.電極Ⅰ接電源負極,電極反應式為2HSO3-+2H++2e-==S2O42-+2H2O
B.質子從電極Ⅱ通過質子膜向電極Ⅰ作定向移動
C.吸收塔中的反應為2NO+2S2O42-+2H2O==N2+4HSO3-
D.每處理2 mol NO,電解池質量減少32 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】假設圖中原電池產生的電壓、電流強度均能滿足電解、電鍍要求,即為理想化①~⑧為各裝置中的電極編號。當K閉合后,下列說法正確的有

①D裝置中純Cu電極反應為:Cu2++2e-=Cu
②整個電路中電子的流動方向為:③→②;①→③;⑦→⑥;⑤→④
③裝置原理上是一個電鍍池(Ag表面鍍Cu),其中Cu作陰極,Ag作陽極
④A裝置中C電極反應為:O2+4e-+2H2O=4OH-
A.①②B.③④C.②③④D.①②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰硫酸(NOSO4H)主要用于染料、醫藥等工業。實驗室制備亞硝酰硫酸的方法如下:將SO2通入盛有濃硫酸和濃硝酸的混合液中,維持體系溫度略低于20℃,攪拌,使其充分反應。反應過程中,亞硝酰硫酸的物質的量和硝酸的物質的量隨時間的變化如圖所示。
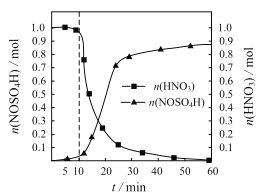
(1)①實驗室制備NOSO4H的化學反應方程式為___。
②反應進行到10min后,反應速度明顯加快,其可能的原因是___。
③反應過程中,硝酸減少的物質的量大于NOSO4H生成的物質的量的可能原因是___
(2)為了測定亞硝酰硫酸的純度,進行如下實驗:。
準確稱取1.200g產品放入錐形瓶中,加入50.00mL0.1000mol·L-1的KMnO4標準溶液和足量稀H2SO4,搖勻,使其充分反應。再將反應后溶液加熱至60~70℃(使生成的HNO3揮發逸出),冷卻至室溫,用0.2500mol·L-1Na2C2O4標準溶液滴定至終點,消耗Na2C2O4溶液的體積為16.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;KMnO4在酸性條件下被還原為Mn2+。
根據以上實驗數據計算亞硝酰硫酸的純度。(寫出計算過程)___
查看答案和解析>>
科目:高中化學 來源: 題型:
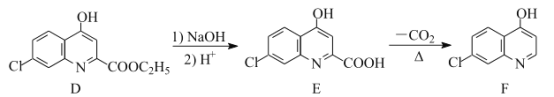
【題目】氯喹是合成一種抑制病毒藥物的中間體,其合成路線如圖:
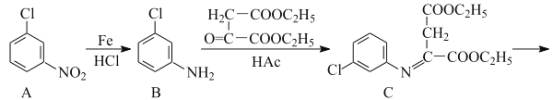
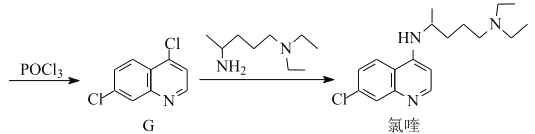
(1)D中含氧官能團的名稱為___和___。
(2)A→B的反應類型為___。
(3)C→D的反應中有副產物X(X與D互為同分異構體)生成,寫出X的結構簡式:
___。
(4)E的一種同分異構體同時滿足下列條件,寫出該同分異構體的結構簡式:___。
①酸性條件下水解得到的兩種有機產物,都能發生銀鏡反應,其中一種與FeCl3溶液發生顯色反應;
②分子中有氰基(-CN),有一個手性碳原子,有4種不同化學環境的氫。
(5)已知:①![]() NH2易被氧化;
NH2易被氧化;
②酰氯(![]() Cl)的氯原子比氯代烴的更易被取代
Cl)的氯原子比氯代烴的更易被取代
③![]() RHC=N-CH2R’
RHC=N-CH2R’
寫出以![]() 和
和![]() 為原料制備
為原料制備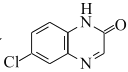 的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)___。
的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是( )
A.碳酸氫鈉的水解方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
B.用高錳酸鉀標準溶液滴定草酸:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O
C.用碳酸氫鈉溶液檢驗水楊酸中的羧基: +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D.向Na2SiO3溶液中滴加稀鹽酸:Na2SiO+2H+=H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在10L恒容密閉容器中充入X(g)和Y(g),發生反應X(g)+Y(g)![]() M(g)+N(g),所得實驗數據如下表:
M(g)+N(g),所得實驗數據如下表:
實驗編號 | 溫度/℃ | 起始時物質的量/mol | 平衡時物質的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列說法不正確的是( )
A.實驗①中,若5min未測得n(M)=0.050mol,則0至5min時間內,用N表示的平均反應速v(N)=1.0×10-3mol·L-1·min-1
B.實驗②中,達到平衡時,Y的轉化率為20%
C.實驗③中,該反應的平衡常數K=1.0
D.實驗④中,達到平衡時, b>0.060
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向濃度均為0.1mol·L-1、體積均為100mL的兩種一元酸HX、HY溶液中分別加入NaOH固體,溶液中![]() 隨n(NaOH)的變化如圖所示。下列說法正確的是
隨n(NaOH)的變化如圖所示。下列說法正確的是

A.HX為弱酸,HY為強酸
B.水的電離程度:b>c>d
C.C點對應的溶液中:c(HY)>c(Y-)
D.若將c點與d點的溶液全部混合,溶液中離子濃度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列各裝置圖的敘述不正確的是( )


A.用圖①裝置實現鐵上鍍銅,a極為銅,電解質溶液可以是CuSO4溶液
B.圖②裝置鹽橋中KCl的Cl-移向右燒杯
C.圖③裝置中鋼閘門應與外接電源的負極相連獲得保護
D.圖④兩個裝置中通過導線的電子數相同時,消耗負極材料的物質的量不同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com