
向甲、乙、丙三個密閉容器中充入一定量的A和B,發生反應:A(g)+xB(g) 2C(g)。各容器的反應溫度、反應物起始量,反應過程中C的濃度隨時間變化關系分別以下圖和下表表示。下列說法正確的是
2C(g)。各容器的反應溫度、反應物起始量,反應過程中C的濃度隨時間變化關系分別以下圖和下表表示。下列說法正確的是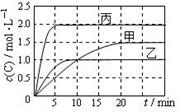
| 容器 | 甲 | 乙 | 丙 |
| 容積 | 0.5L | 0.5L | 1.0L |
| 溫度/℃ | T1 | T2 | T2 |
| 反應物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
AC
解析試題分析:A、由圖可知,10min內甲容器中C的濃度變化量為1mol/L,則v(C)=1mol/L÷10min=0.1mol/(L?min),速率之比等于化學計量數之比,所以v(A)=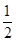 v(C)=
v(C)=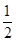 ×0.1mol/(L?min)=0.05mol/(L?min),故A正確;B、比較甲與乙可知,乙先到達平衡,故溫度T1<T2,溫度越高C的濃度越低,升高溫度平衡向逆反應移動,故正反應為放熱反應,故B錯誤;C、若x=1,反應前后氣體的物質的量不變,改變體積壓強不變,不影響平衡移動,故C正確;D、乙中平衡時A的轉化率為
×0.1mol/(L?min)=0.05mol/(L?min),故A正確;B、比較甲與乙可知,乙先到達平衡,故溫度T1<T2,溫度越高C的濃度越低,升高溫度平衡向逆反應移動,故正反應為放熱反應,故B錯誤;C、若x=1,反應前后氣體的物質的量不變,改變體積壓強不變,不影響平衡移動,故C正確;D、乙中平衡時A的轉化率為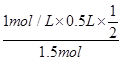 =
=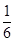 ;丙中A的轉化率為
;丙中A的轉化率為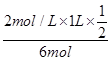 =
=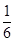 ,丙中壓強為乙中2倍,壓強增大平衡不移動,故x=1,所以T2℃,丙容器比乙容器反應快的原因可能是使用了催化劑,也可能是增大壓強,D不正確,答案選AC。
,丙中壓強為乙中2倍,壓強增大平衡不移動,故x=1,所以T2℃,丙容器比乙容器反應快的原因可能是使用了催化劑,也可能是增大壓強,D不正確,答案選AC。
考點:考查化學反應速率計算、影響化學平衡移動的因素、化學平衡圖象與有關計算


 期末100分闖關海淀考王系列答案
期末100分闖關海淀考王系列答案 小學能力測試卷系列答案
小學能力測試卷系列答案科目:高中化學 來源: 題型:單選題
可逆反應A(g)+3B(g) 2C(g)+2D(g) 在4種不同情況下反應速率分別如下,其中反應速率v最大的是
2C(g)+2D(g) 在4種不同情況下反應速率分別如下,其中反應速率v最大的是
A.v(A)=0.15mol/(L·min) B.v (B)=0.6 mol/(L·min)
C.v (C)=0.3 mol/(L·min) D.v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
使反應4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密閉容器中進行,半分鐘后N2的物質的量增加了0.6mol。此反應的平均速率v(X)為
| A.v(NH3)=0.04mol·L-1·s-1 | B.v(O2)=0.015mol·L-1·s-1 |
| C.v(N2)=0.02mol·L-1·s-1 | D.v(H2O)=0.02mol·L-1·s-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
鎂條和鹽酸反應迅速產生大量的氫氣,欲使反應速率減慢,可采取的措施有:
①降溫;②把鎂條粉碎;③加入蒸餾水使鹽酸變稀;④升溫
| A.①② | B.②③ | C.①③ | D.②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
煤氣化的一種方法是在氣化爐中給煤炭加氫,發生的主要反應為:C(s)+2H2(g) CH4(g)。在VL的容器中投入a mol碳(足量),同時通入2a molH2,控制條件使其發生上述反應,實驗測得碳的平衡轉化率隨壓力及溫度的變化關系如圖所示。下列說法正確的是
CH4(g)。在VL的容器中投入a mol碳(足量),同時通入2a molH2,控制條件使其發生上述反應,實驗測得碳的平衡轉化率隨壓力及溫度的變化關系如圖所示。下列說法正確的是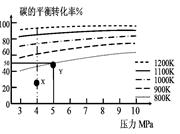
| A.上述正反應為吸熱反應 |
| B.在4MPa、1200K時,圖中X點υ(H2)正 >υ(H2)逆 |
C.在5MPa、800K時,該反應的平衡常數為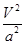 L2·mol-2 L2·mol-2 |
| D.工業上維持6MPa 1000K而不采用10MPa1000K,主要是因 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
100 mL濃度為2 mol/L的鹽酸跟過量的鋅片反應,為減慢反應速率,又不影響生成氫氣的總量,可采用的方法是
| A.加入適量NaCl溶液 | B.加入適量NaOH溶液 |
| C.加入數滴CuCl2溶液 | D.加入適量NaNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
可逆反應aA(g)+bB(g) cC(g)+dD(g)ΔH同時符合下列兩圖中各曲線的規律的( )
cC(g)+dD(g)ΔH同時符合下列兩圖中各曲線的規律的( )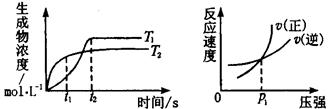
| A.a+b>c+d T1<T2 ΔH<0 |
| B.a+b>c+d T1<T2 ΔH>0 |
| C.a+b<c+d T1>T2 ΔH<0 |
| D.a+b>c+d T1>T2 ΔH>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定條件下,將3molA和1molB兩種氣體混合于固定容積為2L的密閉容器中,發生如下反應:3A(g)+B(g) 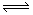 xC(g)+2D(s)。2min末該反應達到平衡,生成0.8molD,并測得C的濃度為0.2mol/L。下列判斷正確的是( )
xC(g)+2D(s)。2min末該反應達到平衡,生成0.8molD,并測得C的濃度為0.2mol/L。下列判斷正確的是( )
| A.該條件下此反應的化學平衡常數約為0.91 |
| B.A的平均反應速率為0.3mol/(L·s) |
| C.B的轉化率為60% |
| D.若混合氣體的密度不再改變時,該反應不一定達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在恒容密閉器中通入物質的量濃度均0.1 mol·L-1的CH4與CO2,在一定條件下發生反應:CO2(g)+CH4(g)  2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度及壓強的關系如下圖,下列有關說法一定正確的是
2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度及壓強的關系如下圖,下列有關說法一定正確的是 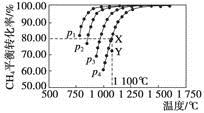
| A.上述反應的ΔH>0 |
| B.壓強p1>p2>p3>p4 |
| C.1 100 ℃該反應的平衡常數為64 |
| D.壓強為p4時,在Y點:v(正)<v(逆) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com