
 2SO3(g);△H = —Q1 KJ/mol,在相同溫度下,向密閉容器中通入2molSO2和1molO2,達(dá)到平衡時(shí)放出熱量Q2KJ,則下列關(guān)系式正確的是
2SO3(g);△H = —Q1 KJ/mol,在相同溫度下,向密閉容器中通入2molSO2和1molO2,達(dá)到平衡時(shí)放出熱量Q2KJ,則下列關(guān)系式正確的是| A.無法比較 | B.Q1<Q2 | C.Q1=Q2 | D.Q1>Q2 |

| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源:不詳 題型:單選題
| A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1 |
| B.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=+1734 kJ·mol-1 |
| C.CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l)ΔH=-x kJ·mol-1 x <574 |
| D.常溫常壓下用2.24 L CH4還原NO2至N2,整個(gè)過程中轉(zhuǎn)移的電子為0.8 mol |
查看答案和解析>>
科目:高中化學(xué) 來源:不詳 題型:單選題
| A.物質(zhì)發(fā)生化學(xué)反應(yīng)的反應(yīng)熱僅指反應(yīng)放出的熱量 |
| B.熱化學(xué)方程式中各物質(zhì)的化學(xué)計(jì)量數(shù)只表示物質(zhì)的量,不表示分子的個(gè)數(shù) |
| C.所有的燃燒反應(yīng)都是放熱的 |
| D.熱化學(xué)方程式中,化學(xué)式前面的化學(xué)計(jì)量數(shù)可以是分?jǐn)?shù) |
查看答案和解析>>
科目:高中化學(xué) 來源:不詳 題型:單選題
| A.需要加熱才能發(fā)生的反應(yīng)就一定是吸熱反應(yīng) |
| B.將Ba(OH)2·8H2O晶體與NH4Cl晶體混合、攪拌,會放出大量的熱 |
| C.在反應(yīng)2CO+O2==2CO2中,反應(yīng)物的總能量高于生成物的總能量 |
| D.1mol CaCO3固體完全分解會吸收178.5kJ的熱量,其熱化學(xué)方程式表示為:CaCO3 ="=" CaO + CO2△H = +178.5kJ·mol-1 |
查看答案和解析>>
科目:高中化學(xué) 來源:不詳 題型:填空題
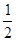 O2(g) === H2O(l) △H=" -" 285.8kJ? mol-1
O2(g) === H2O(l) △H=" -" 285.8kJ? mol-1 查看答案和解析>>
科目:高中化學(xué) 來源:不詳 題型:單選題

| A.△H>0 | B.X能量一定高于M |
| C.該反應(yīng)一定不必加熱就可以發(fā)生 | D.該反應(yīng)為放熱反應(yīng) |
查看答案和解析>>
科目:高中化學(xué) 來源:不詳 題型:單選題
| A.△H>0表示放熱反應(yīng),△H<0表示吸熱反應(yīng) |
| B.M與N是同素異形體,由M=N;△H=+119KJ/mol可知,M比N穩(wěn)定 |
| C.l mol H2SO4與1mol Ba(OH)2反應(yīng)生成BaSO4沉淀時(shí)放出的熱叫做中和熱 |
| D.1 mol H2與0.5 mol O2反應(yīng)放出的熱就是H2的燃燒熱 |
查看答案和解析>>
科目:高中化學(xué) 來源:不詳 題型:單選題
| A.氫氣還原氧化銅 | B.氯化銨與氫氧化鋇晶體混合攪拌 |
| C.碳酸鈣高溫分解成氧化鈣和二氧化碳 | D.金屬鋁片溶于鹽酸中 |
查看答案和解析>>
科目:高中化學(xué) 來源:不詳 題型:單選題
| A.1molH2SO4與1mol Ba(OH)2完全中和所放出的熱量為中和熱 |
| B.中和反應(yīng)都是放熱反應(yīng),鹽類水解反應(yīng)都是吸熱反應(yīng) |
| C.在101kPa1mol碳燃燒所放出的熱量一定是碳的燃燒熱 |
| D.碳與二氧化碳的反應(yīng)既是吸熱反應(yīng),也是化合反應(yīng) |
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺 | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com