
在密閉容器中,存在反應(yīng): ,下列可使化學(xué)反應(yīng)速率增大的措施是( )
,下列可使化學(xué)反應(yīng)速率增大的措施是( )
A.減小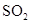 濃度 濃度 | B.升高溫度 | C.增大容器體積 | D.降低溫度 |
 優(yōu)學(xué)名師名題系列答案
優(yōu)學(xué)名師名題系列答案
| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:計(jì)算題
I.工業(yè)上可用CO生產(chǎn)燃料甲醇。一定條件下發(fā)生反應(yīng):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)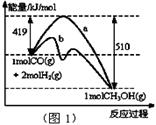
(1)“圖1”表示反應(yīng)中能量的變化,曲線 (填“a或b”)表示使用了催化劑;該反應(yīng)的熱化學(xué)方程式為 。
(2)若容器容積不變,下列措施可增大CO平衡轉(zhuǎn)化率的是_____。
| A.升高溫度 |
| B.將CH3OH(g)從體系中分離 |
| C.充入He,使體系總壓強(qiáng)增大 |
| D.再充入1 mol CO和2 mol H2 |
 BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。查看答案和解析>>
科目:高中化學(xué) 來源: 題型:實(shí)驗(yàn)題
高爐煉鐵是冶煉鐵的主要方法,發(fā)生的主要反應(yīng)為:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
則a = kJ mol-1。
(2)冶煉鐵反應(yīng)的平衡常數(shù)表達(dá)式K = ,溫度升高后,K值 (填“增大”、“不變”或“減小”)。
(3)在T℃時,該反應(yīng)的平衡常數(shù)K=64,在2L恒容密閉容器甲和乙中,分別按下表所示加入物質(zhì),反應(yīng)經(jīng)過一段時間后達(dá)到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
影響化學(xué)反應(yīng)速率與平衡的因素有多方面,如濃度壓強(qiáng)溫度催化劑等。下列有關(guān)說法不正確的是
| A.其它條件不變時,改變壓強(qiáng)能改變氣體反應(yīng)的速率,但不一定改變平衡 |
| B.增大濃度能加快化學(xué)反應(yīng)速率,原因是增大濃度就增加了反應(yīng)體系中活化分子的百分?jǐn)?shù) |
| C.溫度升高使化學(xué)反應(yīng)速率加快的主要原因是增加了反應(yīng)體系中活化分子的百分?jǐn)?shù) |
| D.加入催化劑能降低反應(yīng)所需的活化能,使反應(yīng)速率加快,平衡常數(shù)增大 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
在2 L的密閉容器中發(fā)生反應(yīng)xA(g)+yB(g) zC(g)。圖甲表示200 ℃時容器中A、B、C物質(zhì)的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分?jǐn)?shù)隨起始n(A)∶n(B)的變化關(guān)系。則下列結(jié)論正確的是( )。
zC(g)。圖甲表示200 ℃時容器中A、B、C物質(zhì)的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分?jǐn)?shù)隨起始n(A)∶n(B)的變化關(guān)系。則下列結(jié)論正確的是( )。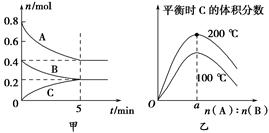
A.200 ℃時,反應(yīng)從開始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃時,該反應(yīng)的平衡常數(shù)為25 L2/mol2
C.當(dāng)外界條件由200℃降溫到100℃,原平衡一定被破壞,且正逆反應(yīng)速率均增大
D.由圖乙可知,反應(yīng)xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
下列敘述錯誤的是
| A.SO2使溴水褪色與乙烯使KMnO4溶液褪色的原理相同 |
| B.制備乙酸乙酯時可用熱的NaOH溶液收集產(chǎn)物以除去其中的乙酸 |
| C.用碳酸鈣粉末替代碳酸鈣塊狀固體與鹽酸反應(yīng),可以加快反應(yīng)速率 |
| D.用AgNO3溶液可以鑒別KC1和KI |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
在一定溫度下,體積固定的密閉容器中,當(dāng)下列物理量:①混合氣體的壓強(qiáng) ② 氣體的總物質(zhì)的量 ③混合氣體的密度 ④ B的物質(zhì)的量濃度不再變化時,能表明可逆反應(yīng) A(s)+2B(g) 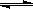 C(g)+D(g) 已達(dá)平衡的是 ( )
C(g)+D(g) 已達(dá)平衡的是 ( )
| A.①② | B.③④ | C.①④ | D.只有④ |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
在鋁與稀硫酸的反應(yīng)中,已知10 s末硫酸的濃度減少了0.6 mol·L-1,若不考慮反應(yīng)過程中溶液體積的變化,則10 s內(nèi)生成硫酸鋁的平均反應(yīng)速率是( )
| A.0.02 mol·L-1·s-1 | B.1.8 mol·L-1·s-1 | C.1.2 mol·L-1·s-1 | D.0.18 mol·L-1·s-1 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:單選題
工業(yè)上可利用甲烷除去NO氣體,反應(yīng)為CH4(g)+4NO(g)  CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密閉容器中,下列有關(guān)說法正確的是( )
CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密閉容器中,下列有關(guān)說法正確的是( )
| A.平衡時,其他條件不變,升高溫度可使該反應(yīng)的平衡常數(shù)增大 |
| B.單位時間內(nèi)消耗CH4和N2的物質(zhì)的量比為1∶2時,反應(yīng)達(dá)到平衡 |
| C.平衡時,其他條件不變,增加CH4的濃度,氮氧化物的轉(zhuǎn)化率減小 |
| D.其他條件不變,使用高效催化劑,廢氣中氮氧化物的轉(zhuǎn)化率增大 |
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com