
【題目】分枝酸可用于生化研究,其結構簡式如右所示。下列關于分枝酸的敘述正確的是( )

A. 可與乙醇、乙酸反應,且反應類型相同
B. 分子中含有2種官能團
C. 1mol分枝酸最多可與3mol NaOH發生中和反應
D. 可使溴的四氯化碳溶液、酸性高錳酸鉀溶液褪色,且原理相同
 華東師大版一課一練系列答案
華東師大版一課一練系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化學 來源: 題型:
【題目】乙二酸俗名草酸,某化學學習小組的同學欲探究測定草酸晶體(H2C2O4·xH2O)中x值。通過查閱資料該小組同學通過網絡查詢得知,草酸易溶于水,水溶液可以用酸性KMnO4溶液進行滴定:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O該組同學設計了滴定的方法測定x值。
① 稱取1.260 g純草酸晶體,將其酸制成100.00 mL水溶液為待測液。
② 取25.00 mL待測液放入錐形瓶中,再加入適量的稀H2SO4
③ 用濃度為0.1000 mol/L的KMnO4標準溶液進行滴定,達到終點時消耗10.00 mL;請回答:
(1)將草酸晶體配制成溶液時,必須用到的玻璃儀器是燒杯、玻璃棒、_____、______。
(2)滴定時,將KMnO4標準液裝在右圖中的________(填“甲”或“乙”)滴定管中。
![]()
(3)本實驗滴定達到終點的標志是________。
(4)通過上述數據,計算出x=________。
(5)下列滴定操作會使測得的x值偏大的是________。
A.滴定終點時俯視滴定管刻度
B. 滴定終點時仰視滴定管刻度
C.滴定時所用的KMnO4溶液因久置而導致濃度變小
D.滴定管尖嘴內在滴定前有氣泡,滴定后氣泡消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣是一種用途廣泛的化工原料。金屬鎵是一種廣泛用于電子工業和通訊領域的重要金屬,鎵元素(31Ga)在元素周期表中位于第四周期IIIA族,化學性質與鋁元素相似。
(1)下圖是當反應器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反應達到平衡時,混合物中NH3的物質的量分數隨壓強的變化曲線。
已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0

①曲線c對應的溫度是_____。
②關于工業合成氨的反應,下列敘述正確的是_____(填字母)。
A.及時分離出NH3可以提高H2的平衡轉化率
B.根據勒夏特列原理,一般采用高溫下發生反應
C.上圖中M、N、Q點平衡常數K的大小關系是K(M)=K(Q)>K(N)
③工業上合成氨的催化劑為鐵觸媒,選擇溫度為500℃的原因是______。
(2)工業上利用Ga與NH3合成固體半導體材料氮化鎵(GaN)同時有氫氣生成。反應中,生成3molH2時就會放出30.8kJ的熱量。
①該反應的熱化學方程式是__________。
②該反應的化學平衡常數表達式是_____。
③在恒溫恒容的密閉體系內進行上述可逆反應,下列有關表達正確的是_____。
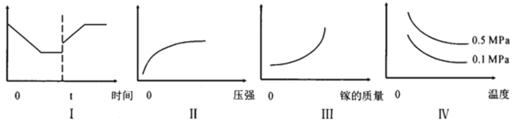
A.I圖像中如果縱坐標為正反應速率,則t時刻改變的條件可以為升溫
B.II圖像中縱坐標可以為鎵的轉化率
C.III圖像中縱坐標可以為化學反應速率
D.Ⅳ圖像中縱坐標可以為體系內混合氣體平均相對分子質量
④氮化鎵(GaN)性質穩定,但能緩慢的溶解在熱的NaOH溶液中,該反應的離子方程式是________。
(3)將一塊鎵鋁合金完全溶于燒堿溶液中得到溶液X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式電離常數Ka | 2×10-11 | 1×10-7 |
堿式電離常數Kb | 1.3×10-33 | 1.4×10-34 |
往X溶液中緩緩通入CO2,最先析出的氫氧化物是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組設計如圖裝置,驗證黃銅礦(主要成分CuFeS2)在空氣中的氧化產物(雜質不參與反應)。

回答下列問題。
(1)儀器a的名稱______,堿石灰的作用______。
(2)為檢驗灼燒黃銅礦產生的氣體,B中可選______
a.HNO3溶液b.品紅溶液c.BaCl2溶液d.溴水e.酸性KMnO4溶液
(3)C中NaOH的作用______。
(4)樣品經煅燒后的固體中銅元素以泡銅(Cu、Cu2O)形式存在,其中Cu2O能與稀硫酸反應生成Cu和CuSO4。
①設計實驗驗證泡銅中含有Cu2O:取少量泡銅置于試管中,________,若________,說明泡銅中含有Cu2O。
②用泡銅與CO反應來制取粗銅,再經精煉可得純銅。將一定量的純銅投入到2L1mol/L的稀硝酸中充分反應,請寫出該反應的離子方程式_______。若銅全部溶解并得到標況下4.48LNO,要使溶液中的Cu2+恰好沉淀,需要向反應后的溶液中加入5mol/L的NaOH溶液____L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用AgNO3溶液分別滴定濃度均為0.0lmol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡圖像如圖所示(不考慮C2O42-的水解)。已知Ksp(AgC1)數量級為10-10。下列敘述不正確的是( )
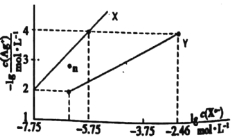
A.圖中Y線代表的Ag2C2O4
B.n點表示AgCl的過飽和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液時,先生成AgC1沉淀
D.Ag2C2O4+2Cl-=2AgC1+C2O42-的平衡常數為1.0×10-0.7l
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F六種元素位于短周期,原子序數依次增大,C基態原子核外有三個未成對電子,B與D形成的化合物BD與C的單質C2電子總數相等,CA3分子結構為三角錐形,D與E可形成E2D與E2D2兩種離子化合物,D與F是同族元素。根據以上信息,回答下列有關問題:
(1)寫出基態時D的電子排布圖_______________________。
(2)寫出化合物E2F2的電子式________,化合物ABC的結構式________。
(3)根據題目要求完成以下填空:BF32-中心原子雜化方式________;D3中心原子雜化方式________;FD42-微粒中的鍵角________;FD3分子的立體構型________。
(4)根據等電子原理,指出與BD2互為等電子體且含有C原子的微粒有________、________(要求寫一種分子和一種離子)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物的用途廣泛,碳元素不僅能形成豐富多彩的有機化合物,而且還能形成多種無機化合物,同時自身可以形成多種單質。
(1)C60分子形成的晶體中,在晶胞的頂點和面心均含有一個C60分子,則一個C60晶胞的質量為____。
(2)干冰和冰是兩種常見的分子晶體,下列關于兩種晶體的比較中正確的是____。
a. 晶體的密度:干冰>冰 b. 晶體的熔點:干冰>冰
c. 晶體中的空間利用率:干冰>冰 d. 晶體中分子間相互作用力類型相同
(3)金剛石和石墨是碳元素形成的兩種常見單質,下列關于這兩種單質的敘述中正確的有____。
a. 金剛石中碳原子的雜化類型為sp3雜化,石墨中碳原子的雜化類型為sp2雜化
b. 晶體中共價鍵的鍵長:金剛石中C-C<石墨中C-C
c. 晶體的熔點:金剛石>石墨
d. 晶體中共價鍵的鍵角:金剛石>石墨
e. 金剛石晶體中只存在共價鍵,石墨晶體中則存在共價鍵、金屬鍵和范德華力
f. 金剛石和石墨的熔點都很高,所以金剛石和石墨都是原子晶體
(4)金剛石晶胞結構如圖所示,立方BN結構與金剛石相似,在BN晶體中,B原子周圍最近的N原子所構成的立體圖形為____,一個晶胞中N原子數目為____。
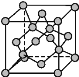
(5)碳與孔雀石共熱可以得到金屬銅,金屬銅采用面心立方最密堆積,即在晶胞的頂點和面心均含有一個Cu原子,則Cu晶體中Cu原子的配位數為___。已知Cu晶體的密度為ρ g·cm-3,Cu的相對原子質量為M,阿伏加德羅常數為NA,則Cu的原子半徑為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前,國家電投集團正在建設國內首座百千瓦級鐵-鉻液流電池儲能示范電站。鐵-鉻液流電池總反應為Fe3++Cr2+![]() Fe2++Cr3+,工作示意圖如圖。下列說法錯誤的是
Fe2++Cr3+,工作示意圖如圖。下列說法錯誤的是

A.放電時a電極反應為Fe 3++e=Fe2+
B.充電時b電極反應為Cr3++e=Cr2+
C.放電過程中H+通過隔膜從正極區移向負極區
D.該電池無爆炸可能,安全性高,毒性和腐蝕性相對較低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[選修5——有機化學基礎] 合成纖維中目前產量占第一位的是聚酯纖維——滌綸。
滌綸是聚對苯二甲酸乙二醇酯的商品名,其結構為:
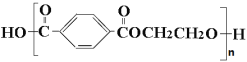
滌綸的一種合成路線如下:
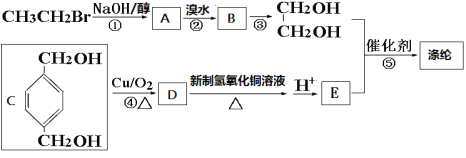
(1)A中官能團的結構式為_____________,反應①、②的反應類型分別為_________、_________,有機物B的名稱是______________________,反應③可用的試劑為___________________。
(2)寫出反應⑤的化學方程式:_______________。
(3)1 mol D與足量銀氨溶液反應可得到____________mol銀單質。
(4)寫出有機物C的同分異構體中,含有苯環,并同時符合下列條件的所有有機物的結構簡式:______________。
a 能發生消去反應 b 能與濃溴水反應生成白色沉淀 c 核磁共振氫譜有6個峰
(5)工業上常用烴F直接氧化來制取有機物E。已知:F的分子式為C8H10,則其結構簡式為________________;F的一種同系物G比F多2個碳原子,其中苯環上只有一個取代基的G的結構有____________種。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com