
【題目】科學家提出硅是“21世紀的能源”,這主要是由于作為半導體材料的硅在太陽能發電過程中具有重要的作用。下列關于硅的說法中正確的是 ( )
A. 自然界硅的貯量豐富
B. 自然界中存在大量單質硅
C. 二氧化硅被用于制作計算機芯片
D. 光導纖維的主要成分是Si
科目:高中化學 來源: 題型:
【題目】下列反應屬于取代反應的是( )
A.乙醇在銅做催化劑下與氧氣反應B.乙烯通入酸性高錳酸鉀溶液
C.溴乙烷與氫氧化鈉的醇溶液共熱D.甲苯與氯氣混合光照
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(15分)化合物H是一種用于合成γ-分泌調節劑的藥物中間體,其合成路線流程圖如下:

(1)C中的含氧官能團名稱為_______和__________。
(2)D→E 的反應類型為__________________________。
(3)寫出同時滿足下列條件的C的一種同分異構體的結構簡式:_____________________。 ①含有苯環,且分子中有一個手性碳原子;②能發生水解反應,水解產物之一是α-氨基酸,另一水解產物分子中只有2種不同化學環境的氫。
(4)G 的分子式為C12H14N2O2 ,經氧化得到H,寫出G的結構簡式:__________________。
(5)已知: ![]() (R代表烴基,R'代表烴基或H) 請寫出以
(R代表烴基,R'代表烴基或H) 請寫出以![]() 和(CH3)2SO4為原料制備
和(CH3)2SO4為原料制備![]() 的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。
的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗小組的同學對一粗鹽樣品進行初步提純。所用實驗儀器或用品如下:

(1)D的名稱是______________。
(2)提純的步驟是:溶解、過濾、_____________。
(3)“過濾”操作的要點可概括為“一貼、二低、三靠”,其中的“二低”是_______________、__________________。
(4)該實驗中多次利用儀器B和儀器_____________(填字母序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬是一種稀有金屬,為人體及動植物必須的微量元素,純金屬鉬和鉬合金具有強度大、耐高溫、耐磨損、耐腐蝕等多種有點,廣泛應用于冶金、機械、化工、軍工、電光源、潤滑劑、航空航天等領域。某化學興趣小組在實驗室模擬了從銅鉬精礦(主要含有Cu2S、MoS2,SiO2,P,As等)中提取分離得到氧化鉬的過程:

已知:MoO3在869.9K溫度下開始升華,而到969.9溫度下激烈升華,在溶液中以H2MoO4形式存在
(1)濾渣1的主要成分為_________________________。
(2)銅鉬礦中的鉬元素在過量的空氣中,于一定溫度下,很容易氧化成MoO3,其方程式為___________________________________,
焙燒過程中應控制在800-870K左右,其原因為____________________________。
(3)①向濾液1中加入的銅抑制劑有多種,如氰化鈉,向含重金屬離子的溶液中添加氰化鈉,會立即生成沉淀,但是若繼續添加氰化鈉,沉淀繼續與CN-反應,生成[Me(CN)4]2-穩定的配離子,因此需要控制氰化鈉的用量,試寫出向濾液中加入過量氰化鈉的離子方程式_______________________________;
②由干氰化鈉有劇毒,所以需要對剩余的氰化鈉進行處理,通常選用深漂白粉或漂白液在酸性條件下將其氧化為兩種空氣中常見無毒氣體,試寫出漂白液與氰化鈉反應的離子方程式_____;
③除氰化鈉外,常用的抑制劑還有亞鐵氰化鈉,Na4[Fe(CN)6]可與重金屬陽離子反應,生成溶度積較小的沉淀,已知Cu2Fe(CN)6的Ksp=1.00×10-16;濾液中的Cu2+的濃度為為0.5mol/L、.當溶液中離子濃度小于等于1.00×10-16mol/L時可認為沉淀完全,則欲處理IL濾液的Na4[Fe(CN)6]體積為_________(體積變化忽略不計,保留兩位小數)。
(4)當NH3∶MoO3等于或稍大于6∶7時,可從氨溶液中結晶出分子式為(NH4)6Mo7O24 4H2O的鹽。蒸發溶液(把氨除去)或中和溶液(化合部分氨)都可以達到這一比例。則操作I為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人類活動產生的CO2長期積累,威脅到生態環境,其減排問題受到全世界關注。
(1)工業上常用高濃度的K2CO3 溶液吸收CO2,得溶液X,再利用電解法使K2CO3 溶液再生,其裝置示意圖如圖:

在陽極區發生的反應包括 和H ++ ![]()
![]() H2O + CO2↑。簡述
H2O + CO2↑。簡述![]() 在陰極區再生的原理 。
在陰極區再生的原理 。
(2)再生裝置中產生的CO2和H2在一定條件下反應生成甲醇等產物,工業上利用該反應合成甲醇。已知:25 ℃,101 kPa下:H2(g) +![]() O2(g)
O2(g) ![]() H2O(g) Δ H1= 242 kJ/mol
H2O(g) Δ H1= 242 kJ/mol
CH3OH(g) +![]() O2(g)
O2(g) ![]() CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol
CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol
① 寫出CO2和H2生成氣態甲醇等產物的熱化學方程式 。
②下面表示合成甲醇的反應的能量變化示意圖,其中正確的是 (填字母序號)。

(3)在密閉的再生裝置中,加入5 mol H2與2 mol CO2發生反應生成甲醇,反應達到平衡時,改變溫度(T)和壓強(p),反應混合物中甲醇(CH3OH)的物質的量分數變化情況如圖所示,下列說法正確的是 。

A.p1> p2> p3>p4
B.甲醇的物質的量分數越高,反應的平衡常數越大
C.圖示中,該反應的溫度變化為:T1> T2> T3>T4
D.T4、p4時,H2的平衡轉化率為60%
(4)已知某種甲醇燃料電池中,電解質溶液為酸性,示意圖如下:工作結束后,B電極室溶液的pH與工作前相比將 (填寫“增大”、“減小”或“不變”,溶液體積變化忽略不計)。A電極附近甲醇發生的電極反應式為 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:還原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物質的量的關系曲線如圖所示。下列說法不正確的是
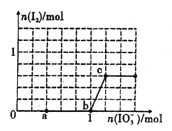
A. 0-a段發生反應:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物質的量為1.8mol
C. b~c段反應:氧化產物為I2
D. 當溶液中I-與I2的物質的量之比為5 : 1時,加入的KIO3為1.lmol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用一種陰、陽離子雙隔膜三室電解槽處理廢水中的NH4+,模擬裝置如下圖所示。下列說法不正確的是

A. 陽極室溶液由無色變成淺綠色
B. 當電路中通過lmol電子的電量時,陰極有0.5mol的氣體生成
C. 電解時中間室(NH4)2SO4溶液濃度下降
D. 電解一段時間后,陰極室溶液中的溶質一定是(NH4)3PO4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com