
【題目】下列是某興趣小組根據課本實驗設計的一個能說明碳酸鈉與碳酸氫鈉熱穩定性的套管實驗。甲為小蘇打,乙為純堿。請觀察下圖的實驗裝置、分析實驗原理,下列說法錯誤的是( )

A. 丁燒杯中的石灰水先變渾濁,丙中石灰水后來變渾濁
B. 要證明碳酸氫鈉受熱能產生水,可在小試管內塞上沾有無水硫酸銅粉末的棉花球
C. 整個實驗過程中可以看到丙燒杯的澄清石灰水沒變渾濁
D. 通過本實驗可對比小蘇打和純堿的熱穩定性
【答案】A
【解析】A.碳酸氫鈉不穩定,加熱分解生成二氧化碳氣體,所以丁燒杯中的石灰水先變渾濁;碳酸鈉較穩定,加熱過程中不會分解,則連接丙燒杯的試管不會產生二氧化碳,所以丙燒杯的澄清石灰水不變渾濁,故A錯誤;B.白色的無水硫酸銅遇到水顯示藍色,則證明碳酸氫鈉受熱能產生水,可在小試管內塞上沾有無水硫酸銅粉末的棉花球,如果變藍則說明有水生成,故B正確;C、碳酸鈉較穩定,加熱過程中不會分解,則連接丙燒杯的試管不會產生二氧化碳,所以丙燒杯的澄清石灰水不變渾濁,故C正確; D.碳酸氫鈉在小試管,碳酸鈉在大使管,大試管直接加熱,溫度較高,如溫度較高的不分解,而加熱溫度較低的物質分解,可判斷穩定強弱,故D正確。


 新思維假期作業寒假吉林大學出版社系列答案
新思維假期作業寒假吉林大學出版社系列答案科目:高中化學 來源: 題型:
【題目】溫度不變恒容的容器中0.1molL﹣1H2進行反應H22H,若某段時間內H2濃度由0.06molL﹣1降到0.036molL﹣1所需的反應時間為12s,則反應起始時H2濃度由0.1molL﹣1降到0.06molL﹣1需的時間為( )
A.等于24s
B.等于20s
C.大于20s
D.小于20s
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某反應中反應物與生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一種未知物質X。
(1)已知KBrO3在反應中得到電子,則該反應的還原劑是____________。
(2)已知0.2mol KBrO3在反應中得到1mol電子生成X,則X的化學式為____________。
(3)根據上述反應可推知___________。
a.氧化性:H3AsO4>KBrO3
b.氧化性:KBrO3>H3AsO4
c.還原性:X>AsH3
d.還原性:AsH3>X
(4)將氧化劑和還原劑的化學式及其配平后的系數填入下列方框中,并標出電子轉移的方向和數目___________
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綜合利用海水可以制備食鹽、純堿、金屬鎂、溴等物質,其流程如圖所示: 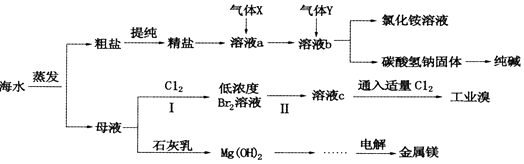
(1)利用海水可制備C12 , 為便于儲存,可將C12液化,應采取的措施之一是 .
(2)粗鹽中含有硫酸鈉、氯化鎂、氯化鈣等可溶性雜質,為除去這些雜質而得精鹽,進行如下操作:①溶解 ②加過量的BaCl2溶液 ③加過量的NaOH溶液 ④加過量的Na2CO3溶液 ⑤(填操作名稱,下同) ⑥加適量的鹽酸 ⑦
(3)氣體X為 . 溶液b中發生反應的化學方程式是 .
(4)步驟I中已獲得Br2 , 步驟Ⅱ中又將Br2還原為Br﹣ , 其目的為 . 步驟Ⅱ中通入空氣吹出Br2 , 用SO2水溶液進行吸收,得到溶液c,反應的離子方程式為 . 在實驗室中,從工業溴中提取溴單質的實驗操作名稱是 .
(5)工業上制取金屬鎂的化學方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是可逆反應 2Y2Z2 在反應過程中的反應速率(v)與時間(t)的關系曲線,下列敘述正確的是( ) 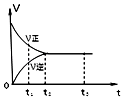
A.t1時,只有正方向反應
B.t2﹣t3 , 反應不再發生
C.t2﹣t3 , 各物質的濃度均沒有發生變化
D.t2時,反應到達限度,正反應和逆反應速率相等且等于零
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化合物由兩種單質直接反應生成,將其加入Ba(HCO3)2溶液中同時有氣體和沉淀產生。下列化合物中符合上述條件的是( )
A.AlCl3
B.Na2O
C.FeCl2
D.SiO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子,在溶液中因發生氧化還原反應而不能大量共存的是( )
A.K+、NH4+、NO3-、OH-
B.Na+、Ca2+、H+、HCO3-
C.K+、H+、NO3-、I-
D.K+、NO3-、Cl-、Mg2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃時,在2L恒容密閉容器中氣態物質X、Y、Z的物質的量隨時間變化的部分數據如表所示:
T/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)寫出該反應的化學方程式
(2)反應進行到10min,X的轉化率為 , 0~5min內Y的平均反應速率為
(3)計算T℃時該反應的平衡常數K=
(4)T℃下向該密閉容器中通入一定量的X、Y、Z,反應到某時刻測得X、Y、Z的物質的量分別為1.00mol、0.50mol、1.60mol,則此時正逆反應速率大小:v正v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5時刻分別改變該反應的某一反應條件,得到X、Z的物質的量及反應速率與時間的關系如圖A、B所示: 
①10min時改變的反應條件是
②t3時刻改變的反應條件是t5時刻改變的反應條件是 , 理由是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2O2是中學化學常用的強氧化劑,除了能與CO2、H2O反應外,還可與其他還原劑如H2、C發生反應,某化學課外興趣小組為探究Na2O2與H2的反應情況,設計了如下圖所示裝置進行有關實驗。
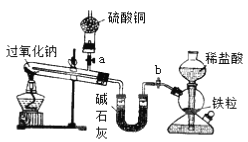
(1)此裝置中,怎樣檢查除啟普發生器之外的裝置的氣密性?_________________________________。
(2)請完成該實驗的有關操作步驟。
①檢查裝置氣密性;
②打開a、b產生氫氣,觀察試管內物質的顏色變化;
③____________________________________________________;
④加熱過氧化鈉,觀察試管內物質的顏色變化;
⑤反應完全后,__________________________________________;
⑥拆卸裝置。
(3)該裝置中,堿石灰的作用是_________________________ 。
(4)實驗過程中觀察到(2)中步驟②無明顯變化,步驟④Na2O2熔化后,黃色粉末立即變成白色,干燥管內硫酸銅未變成藍色。則Na2O2與H2反應的化學方程式為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com