
【題目】下列圖示與對應的敘述相符合的是
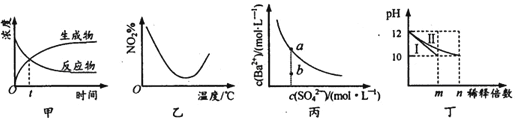
A. 圖甲表示某可逆反應中物質濃度隨時間的變化,反應在t時刻達到平衡狀態
B. 圖乙表示NO2在恒容密閉容器中發生反應:2NO2(g)![]() N2O4(g),NO2體積分數與溫度的變化曲線,則該反應的正反應△H<O
N2O4(g),NO2體積分數與溫度的變化曲線,則該反應的正反應△H<O
C. 圖丙表示某溫度時,BaSO4在水中的溶解平衡曲線,蒸發水可使溶液由b點變到a點
D. 圖丁表示分別稀釋l0mLpH均為12的NaOH和NH3·H2O溶液時pH的變化,曲線I表示NH3 H2O溶液,n>100
科目:高中化學 來源: 題型:
【題目】在溫度T1和T2時,分別將0.50 mol CH4和1.20 mol NO2充入體積為1 L的密閉容器中,發生如下反應:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),測得n(CH4)隨時間變化數據如下表:
N2(g)+CO2(g)+2H2O(g),測得n(CH4)隨時間變化數據如下表:
時間/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列說法正確的是( )
A. T1時0~10 min NO2的平均反應速率為0.15 mol·L-1·min -1
B. T2時CH4的平衡轉化率為70.0%
C. 保持其他條件不變,T1時向平衡體系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反應方向移動
D. 保持其他條件不變,T1時向平衡體系中再充入0.50 mol CH4和1.20 mol NO2,與原平衡相比,達新平衡時N2的濃度增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下表為元素周期表的一部分,請回答有關問題:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符號是________(填寫元素符號)。
(2)表中金屬性最強的元素是____(填元素符號),該元素在周期表中的位置是_______。
(3)寫出①、③、④最高價氧化物對應的水化物兩兩反應的化學方程式
_________________________________
_________________________________
_________________________________
(4)請設計一個實驗方案,比較⑦、⑧非金屬性的強弱(用化學方程式表示):_______。
(5)③、⑦兩種元素形成的化合物的電子式為_____,⑦的氣態氫化物的電子式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 用Ba(OH)2溶液吸收氯氣:2OH-+ 2Cl2 =2Cl-+ClO-+H2O
B. Cu 溶于稀HNO3: Cu + 2H++ NO3- = Cu2+ + NO2↑+ H2O
C. NO2溶于水:3NO2+H2O =2H++2NO3- +NO
D. 氯化鎂溶液與氨水反應:Mg2+ + 2OH-= Mg(OH)2↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩份體積相同,濃度未知的Na2CO3和HCl溶液,將它們互相滴加,產生的氣體在相同的溫度和壓強下的體積比為1:3,則Na2CO3和HCl溶液的濃度之比為( )
A. 5:6 B. 2:5 C. 3:4 D. 5:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,下列指定溶液中微粒的濃度關系正確的是
A. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
B. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.2mol ·L-1H2C2O4(弱酸)與0.1mol ·L-1 NaOH溶液等體積混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
D. 0.1mol ·L-1Na2CO3溶液與同濃度等體積鹽酸混合的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】自然界水體中的碳元素主要以碳酸鹽、碳酸氫鹽和有機物形式存在。水體中有機物含量是水質的重要指標,常用總有機碳衡量(總有機碳=![]() )。某學生興趣小組用如下實驗方法測定采集水樣的總有機碳。
)。某學生興趣小組用如下實驗方法測定采集水樣的總有機碳。

步驟1:量取50 mL水樣,加入足量硫酸,加熱,通N2,并維持一段時間(裝置如圖,夾持類儀器省略)。
步驟2:再向水樣中加入過量的K2Cr2O7溶液(可將有機物中的碳元素氧化成CO2),加熱,充分反應,生成的CO2完全被100mL 0.206 mol·L-1的Ba(OH)2溶液吸收。
步驟3:將吸收CO2后的濁液過濾并洗滌沉淀,再將洗滌得到的濾液與原濾液合并,加水配制成500mL溶液。量取25.00mL溶液于錐形瓶中,加入幾滴酚酞試劑,并滴加0.05mol·L-1的H2C2O4溶液,發生反應:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O 恰好完全反應時,共消耗H2C2O4溶液20.00 mL。
(1)步驟1的目的是____。
(2)用H2C2O4溶液滴定至終點時,溶液顏色變化是____。
(3)計算水樣的總有機碳(以mg·L-1表示),并寫出計算過程。____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗操作和實驗現象所得到的實驗結論正確的是
選項 | 實驗操作 | 現象 | 結論 |
A | 向亞硫酸鈉試樣中滴入鹽酸酸化的Ba(C1O)2溶液 | 產生白色沉淀 | 試樣已氧化變質 |
B | 向氯仿樣品中加入硝酸銀溶液 | 有白色沉淀產生 | 樣品已變質 |
C | 向待測液中依次滴入氯水和KSCN溶液 | 溶液變為紅色 | 待測液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和氣體產生 | AlO2-與HCO3-發生了雙水解反應 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組設計了一組實驗來探究元素周期律。
甲同學根據元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖裝置來一次性完成碳族元素中C與Si的非金屬性強弱比較的實驗研究;
乙同學設計了如圖裝置來驗證鹵族元素性質的遞變規律。A、B、C三處分別是沾有NaBr溶液的棉花、濕潤的淀粉KI試紙、濕潤紅紙。已知常溫下濃鹽酸與高錳酸鉀能反應生成氯氣。
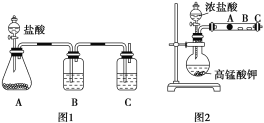
((1)甲同學設計實驗的依據是強酸制弱酸,請回答下列問題
A中錐形瓶裝入的是碳酸鈣固體,A中發生的離子方程式為:_____,
B應放入的物質是____,其作用為____;
C中是Na2SiO3溶液該反應的離子方程式為___________。
(2)乙同學的實驗原理是強氧化劑生成弱氧化劑。
如果A處的棉花由白色變成棕色,則A處的離子方程式為___,B處的現象是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com