
【題目】對于工業合成氨反應:N2+3H2![]() 2NH3,下列說法錯誤的是( )
2NH3,下列說法錯誤的是( )
A.使用合適的催化劑可以加大反應速率B.升高溫度可以增大反應速率
C.增大N2濃度可以使H2完全反應D.增大N2濃度可以增大反應速率
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】實驗室用燃燒法測定某種氨基酸(CxHyOzNm)的分子組成。取Wg該種氨基酸放在純氧中充分燃燒,生成二氧化碳、水和氮氣。按下圖所示裝置進行實驗。

回答下列問題:
(1)實驗開始時,首先通入一段時間的氧氣,其理由是__________________。
(2)以上裝置中需要加熱的儀器有_______ (填寫字母),操作時應先點燃_____處的酒精燈。
(3)A裝置中發生反應的化學方程式是____________________________。
(4)D裝置的作用是____________________________。
(5)讀取氮氣的體積時,應注意①_________________;②_________________。
(6)實驗中測得氮氣的體積為VmL(標準狀況),為確定此氨基酸的分子式,還需要的有關數據有____________________。
A.生成二氧化碳氣體的質量
B.生成水的質量
C.通人氧氣的體積
D.氨基酸的相對分子質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】華法林(Warfarin)又名殺鼠靈,為心血管疾病的臨床藥物。其合成路線(部分反應條件略去)如下所示:
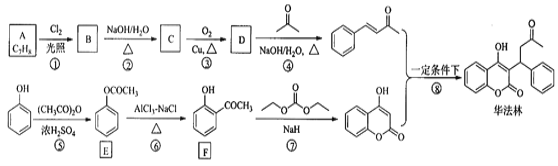
回答下列問題:
(1)A的名稱為________,E中官能團名稱為________。
(2)B的結構簡式為________。
(3)由C生成D的化學方程式為___________
(4)⑤的反應類型為_________,⑧的反應類型為________。
(5)F的同分異構體中,同時符合下列條件的同分異構體共有___________種。
a.能與FeCl3溶液發生顯色反應 b.含有-CHO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某二元酸(化學式用H2X表示)在水中的電離方程式是:H2X=H++HX- HX-![]() H++X2-,常溫下,向10 mL 0.1000 mol/L的H2X溶液中逐滴加入0.1000 mol/L的NaOH溶液,pH隨NaOH溶液體積的變化如圖所示。下列敘述中正確的是
H++X2-,常溫下,向10 mL 0.1000 mol/L的H2X溶液中逐滴加入0.1000 mol/L的NaOH溶液,pH隨NaOH溶液體積的變化如圖所示。下列敘述中正確的是
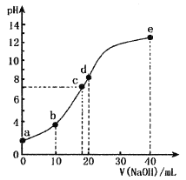
A.a點pH>1
B.b點溶液中:c(Na+)>c(HX-)>c(X2-)>c(H2X)>c(H+)>c(OH-)
C.d點溶液中:c(Na+)=2c(X2-)+2c(HX-)
D.水的電離程度:c>a>e
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生成水的能量關系如圖所示:下列說法不正確的是
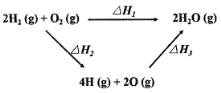
A.△H2>0
B.若2H2(g)+O2(g)=2H2O(l) △H4,則△H4<△H1
C.一定條件下,氣態原子生成1 mol H-O放出a kJ熱量,則該條件下△H3=-4akJ/mol
D.△H1+△H2+△H3=0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵的許多化合物在生產、生活中有著廣泛的應用,如FeCl3是重要的金屬蝕刻劑、水處理劑;影視作品拍攝中常用Fe(SCN)3溶液模擬血液;FeS可用于消除水中重金屬污染等。
(1)已知:①3Cl2(g)+2Fe(s)=2FeCl3(s) ΔH1=akJ·mol-1
②2FeCl2(s)+Cl2(g)=2FeCl3(s) ΔH2=bkJ·mol-1
則2FeCl3(s)+Fe(s)=3FeCl2(s) ΔH3=____。
(2)將c(FeCl3)=0.2mol·L-1的溶液與c(KSCN)=0.5mol·L-1的溶液按等體積混合于某密閉容器發生反應:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,測得常溫下溶液中c(Fe3+)的濃度隨著時間的變化如圖1所示;測得不同溫度下t1時刻時溶液中c[Fe(SCN)3]如圖2所示。
Fe(SCN)3+3KCl,測得常溫下溶液中c(Fe3+)的濃度隨著時間的變化如圖1所示;測得不同溫度下t1時刻時溶液中c[Fe(SCN)3]如圖2所示。
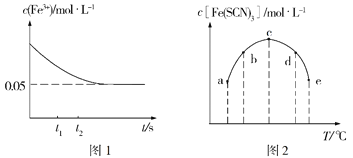
①研究表明,上述反應達到平衡后,向體系中加入適量KCl固體后,溶液顏色無變化,其原因是___,根據圖1分析,在t1、t2時刻,生成Fe3+的速率較大的是____時刻。
②常溫下Fe3++3SCN-![]() Fe(SCN)3的平衡常數的值約為___,其它條件不變時,若向容器中加適量蒸餾水,則新平衡建立過程中v(正)___v(逆)(填“>”“<”或“=”)。
Fe(SCN)3的平衡常數的值約為___,其它條件不變時,若向容器中加適量蒸餾水,則新平衡建立過程中v(正)___v(逆)(填“>”“<”或“=”)。
③根據圖2判斷,該反應的ΔH___0(填“>”或“<”),圖中五個點對應的狀態中,一定處于非平衡態的是___(填對應字母)。
(3)利用FeS可除去廢水中的重金屬離子,如用FeS將Pb2+轉化為PbS可消除Pb2+造成的污染,當轉化達到平衡狀態時,廢水中c(Fe2+)=___c(Pb2+)[填具體數據,已知Ksp(PbS)=8×10-28,Ksp(FeS)=6×10-18]。
查看答案和解析>>
科目:高中化學 來源: 題型:
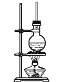
【題目】硬脂酸甘油酯在堿性條件下水解的裝置如圖所示。
進行皂化反應實驗的操作步驟如下:
(1)在圓底燒瓶中加入7~8g硬脂酸甘油酯,然后加入2~3gNaOH、5mL水和10mL酒精,其中加入酒精的作用是___。
(2)加熱反應混合物約10min,皂化反應基本完成,所得的混合物為___(填“懸濁液”、“乳濁液”、“溶液”或“膠體”)。
(3)向所得混合物中加入食鹽細粒,靜置一段時間,溶液分為上下兩層,高級脂肪酸鈉鹽在___層,這個過程稱為___。
(4)裝置中長玻璃導管的作用為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化工廠制備凈水劑硫酸鐵銨晶體![]() 的一種方案如下:
的一種方案如下:
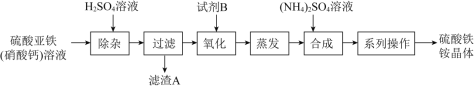
下列說法不正確的是![]()
![]()
A.濾渣A的主要成分是![]()
B.“系列操作”包括蒸發濃縮、降溫結晶、過濾、干燥等
C.相同條件下,![]() 溶解度
溶解度![]() e2(SO4)3小
e2(SO4)3小
D.“氧化”反應中試劑B可選NaClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氣轉變為甲醇過程中,涉及如下反應:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8kJ/mol,現向體積為2L的恒容絕熱(起始溫度為T)密閉容器中充入1 mol CO和2 mol H2,反應經5min后達到平衡,測得CO的轉化率為50%。下列說法不正確的是
CH3OH(g) △H=-90.8kJ/mol,現向體積為2L的恒容絕熱(起始溫度為T)密閉容器中充入1 mol CO和2 mol H2,反應經5min后達到平衡,測得CO的轉化率為50%。下列說法不正確的是
A.在0~5min內,v(H2)=0.1 mol·L-1·min-1
B.當反應達到平衡時,CO和H2的物質的量之比為1:2
C.其他條件不變時,若將該體系換成恒溫(起始溫度為T)恒容密閉容器,則CO的平衡轉化率將增大
D.5min后,將甲醇液化分離出,此時平衡正向移動,正反應速率增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com