
【題目】A、B、D是由常見的短周期非金屬元素形成的單質,常溫下A是淡黃色粉末,B、D是氣體,F、G、H的焰色反應均為黃色,水溶液均顯堿性,E有漂白性。它們之間的轉化關系如圖所示(部分產物及反應條件已略去),回答下列問題:
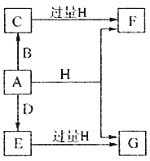
(1)A所含元素在周期表中的位置為______________,C的電子式為_______________。
(2)A與H在加熱條件下反應的化學方程式為__________________。
(3)將A溶于沸騰的G溶液中可以制得化合物I,I在酸性溶液中不穩定,易生成等物質的量的A和E,I在酸性條件下生成A和E的離子方程式為____________________。I是中強還原劑,在紡織、造紙工業中作為脫氯劑,向I溶液中通入氯氣可發生反應,參加反應的I和氯氣的物質的量比為1:4,該反應的離子方程式為__________________。
(4)向含有0.4molF、0.1molG的混合溶液中加入過量鹽酸,完全反應后收集到aL氣體C(標準狀況),取反應后澄清溶液,加入過量FeCl3溶液,得到沉淀3.2g,則a=____________________。
【答案】 第三周期 第ⅥA族 ![]() 3S + 6NaOH
3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O 2H+ + S2O32-
2Na2S + Na2SO3 + 3H2O 2H+ + S2O32- ![]() S↓+ SO2↑+H2O 4Cl2 +S2O32-+ 5H2O
S↓+ SO2↑+H2O 4Cl2 +S2O32-+ 5H2O![]() 8Cl- + 2SO42- + 10H+ 2.24
8Cl- + 2SO42- + 10H+ 2.24
【解析】常溫下A是淡黃色粉末,且為單質,則A是硫;B、D是氣體,A和D生成E,E有漂白性,說明E為SO2,D是O2,則B是H2,C為H2S,F、G、H的焰色反應均為黃色,F、G、H中均含有鈉元素,水溶液均顯堿性,SO2和H2S均能與H反應,H為NaOH,則F為Na2S,G為Na2SO3,(1)A是硫單質,位于第三周期ⅥA元素,C為H2S,屬于共價化合物,其電子式為![]() ;(2)硫單質與熱的氫氧化鈉溶液發生歧化反應,生成硫化鈉和亞硫酸鈉,即反應方程式為:3S + 6NaOH
;(2)硫單質與熱的氫氧化鈉溶液發生歧化反應,生成硫化鈉和亞硫酸鈉,即反應方程式為:3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O;(3)S和沸騰Na2SO3得到化合物Na2S2O3,Na2S2O3在酸性條件下生成S和SO2,即離子反應方程式為:2H+ + S2O32-
2Na2S + Na2SO3 + 3H2O;(3)S和沸騰Na2SO3得到化合物Na2S2O3,Na2S2O3在酸性條件下生成S和SO2,即離子反應方程式為:2H+ + S2O32- ![]() S↓+ SO2↑+H2O,氯氣具有強氧化性,能把S2O32-氧化成SO42-,本身被還原成Cl-,Na2SO3和氯氣的物質的量之比為1:4,即兩者的系數為1:4,S2O32-+4Cl2→2SO42-+8Cl-,根據化學反應方程式原子個數守恒,反應前少5個O,即缺少5molH2O,則生成物中應有10H+,其離子反應方程式為4Cl2+S2O32-+5H2O=8Cl-+2SO42-+10H+;(4)反應后澄清溶液,加入過量FeCl3溶液,得到沉淀3.2g,根據反應2Fe3++S2-=2Fe2++S↓,該反應中消耗的Na2S為0.1mol;Na2S與Na2SO3的混合溶液中加入過量鹽酸,發生反應:2S2-+SO32-+6H+=3S↓+3H2O,消耗Na2SO3 0.1mol,剩余的Na2S 0.1mol與鹽酸反應放出H2S,放出H2S的物質的量為0.1mol,標準狀況下的體積為2.24L。
S↓+ SO2↑+H2O,氯氣具有強氧化性,能把S2O32-氧化成SO42-,本身被還原成Cl-,Na2SO3和氯氣的物質的量之比為1:4,即兩者的系數為1:4,S2O32-+4Cl2→2SO42-+8Cl-,根據化學反應方程式原子個數守恒,反應前少5個O,即缺少5molH2O,則生成物中應有10H+,其離子反應方程式為4Cl2+S2O32-+5H2O=8Cl-+2SO42-+10H+;(4)反應后澄清溶液,加入過量FeCl3溶液,得到沉淀3.2g,根據反應2Fe3++S2-=2Fe2++S↓,該反應中消耗的Na2S為0.1mol;Na2S與Na2SO3的混合溶液中加入過量鹽酸,發生反應:2S2-+SO32-+6H+=3S↓+3H2O,消耗Na2SO3 0.1mol,剩余的Na2S 0.1mol與鹽酸反應放出H2S,放出H2S的物質的量為0.1mol,標準狀況下的體積為2.24L。


科目:高中化學 來源: 題型:
【題目】25℃時,部分物質的電離平衡常數如表所示:
化學式 | CH3COOH | H2C2O4 | H2S |
電離平衡常數 | 1.8×10﹣5 | Ka1=5.4×10﹣2 | Ka1=1.3×10﹣7 |
請回答下列問題:
(1)H2S的一級電離常數表達式為Ka1=
(2)CH3COOH、H2C2O4、H2S的酸性由強到弱的順序
(3)H2C2O4與少量的KOH溶液反應的化學方程式:
(4)NaHS溶液與NaHC2O4溶液反應的離子方程式:
(5)H+濃度相同等體積的兩份溶液A(鹽酸)和B(CH3COOH)分別與鋅粉反應,若最后僅有一份溶液中存在鋅,放出氫氣的質量相同,則下列說法正確的是(填寫序號). ①反應所需要的時間B>A
②開始反應時的速率A>B
③參加反應的鋅的物質的量A=B
④反應過程的平均速率B>A
⑤B中有鋅剩余.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖曲線a表示放熱反應X(g)+Y(g)Z(g)+M(g)+N(s)進行過程中X的轉化率隨時間變化的關系,若要改變起始條件,使反應過程按b曲線進行,可采取的措施是( ) 
A.減壓
B.加大X的投入量
C.升高溫度
D.減小體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組要完成中和熱的測定.
(1)實驗桌上備有大、小兩個燒杯、泡沫塑料、泡沫塑料板、膠頭滴管、環形玻璃攪拌棒、0.5molL﹣1鹽酸、0.55molL﹣1NaOH溶液,實驗尚缺少的玻璃用品是、 .
(2)實驗中能否用環形銅絲攪拌棒代替環形玻璃攪拌棒?(填“能”或“否”),其原因是 .
(3)他們記錄的實驗數據如下:
實驗用品 | 溶液溫度 | 中和熱 | ||
t1 | t2 | △H | ||
① | 50 mL0.55 molL﹣1NaOH溶液 | 20℃ | 23.3℃ | |
50 mL0.5 molL﹣1HCl溶液 | ||||
② | 50 mL0.55 molL﹣1NaOH溶液 | 20℃ | 23.5℃ | |
50 mL0.5 molL﹣1HCl溶液 | ||||
已知:Q=cm(t2﹣t1),反應后溶液的比熱容c為4.18J℃﹣1g﹣1 , 各物質的密度均為1gcm﹣3 .
①計算完成上表△H=(保留2位小數).
②根據實驗結果寫出NaOH溶液與HCl溶液反應的熱化學方程式: .
(4)若用KOH代替NaOH,對測定結果(填“有”或“無”)影響;若用醋酸代替HCl做實驗,對測定結果填“有”或“無”)影響.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為結晶牛胰島素分子結構示意圖。已知胰島素含有A、B兩條多肽鏈,A鏈含有21個氨基酸,B鏈含有30個氨基酸,兩條多肽鏈間通過兩個二硫鍵(二硫鍵由兩個—SH脫掉兩個氫連接而成)連接,在A鏈上也形成1個二硫鍵。則胰島素分子中含有的肽鍵數和51個氨基酸脫水縮合形成胰島素后,相對分子質量比原來減少的數值各是( )
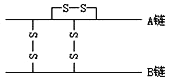
A. 49 882 B. 49 888 C. 50 882 D. 50 888
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2A(g)+B(g)=3C(g)+4D(g)反應中,表示該反應速率最快的數據是( )
A.v(A)=0.9 mol/(Ls)
B.v(B)=0.5 mol/(Ls)
C.v(C)=1.4 mol/(Ls)
D.v(D)=1.8 mol/(Ls)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應3H2+N2 ![]() 2NH3在密閉容器中進行.下列關于該反應的說法錯誤的是( )
2NH3在密閉容器中進行.下列關于該反應的說法錯誤的是( )
A.升高溫度能加快反應速率
B.使用恰當的催化劑能加快反應速率
C.增大N2的濃度能加快反應速率
D.平衡時各組分含量之比一定等于3:1:2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com