
【題目】下列用于解釋事實的離子方程式不正確的是( )
A.向AgCl懸濁液中加入Na2S溶液,有黑色難溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固體,溶液紫色褪去:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
C.向NaHCO3溶液中加入過量澄清石灰水,有白色沉淀生成:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向稀硝酸中加入銅粉,溶液變藍色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【答案】C
【解析】
A.向AgCl懸濁液中加入Na2S溶液,有黑色難溶物生成,氯化銀沉淀轉化為硫化銀,反應離子方程式是2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq),正確,A不選;
Ag2S(s)+2Cl-(aq),正確,A不選;
B.向酸性KMnO4溶液中加入NaHSO3固體,HSO3-被高錳酸鉀氧化為SO42-,溶液紫色褪去,反應的離子方程式是2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O,正確,B不選;
C.向NaHCO3溶液中加入過量澄清石灰水,生成碳酸鈣沉淀、氫氧化鈉、水,反應的離子方程式是HCO3-+Ca2++OH-=CaCO3↓+H2O,錯誤,C選;
D.向稀硝酸中加入銅粉生成硝酸銅、一氧化氮、水,反應的離子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,正確,D不選。
答案選C。


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
【題目】如圖所示電池是一種新型儲氫材料—鎳電池(MHn—Ni),(MHn中金屬和氫都為 0 價)。下列有關說法不正確的是
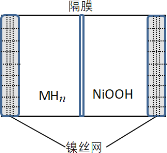
A.放電時正極反應為 NiOOH+H2O+e-→Ni(OH)2+OH-
B.電池的電解液可為KOH 溶液
C.充電時陰極反應為 MHn+nOH--e-→nH2O+M
D.MHn 是一類儲氫材料,n 越大,電池的比能量越高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀態下,氣態分子斷開1 mol化學鍵的焓變稱為鍵焓。已知H—H、H—O和O===O鍵的鍵焓ΔH分別為436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列熱化學方程式正確的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學用語正確的是( )
A. 某元素基態原子的電子排布圖![]()
B. NH4Cl電子式為[![]() :H]+Cl-
:H]+Cl-
C. Ca2+基態電子排布式為1s22s22p63s23p6
D. α羥基丙酸(乳酸)的比例模型為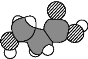
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列“實驗結論”與“實驗操作及現象”相符的一組是
選項 | 實驗操作及現象 | 實驗結論 |
A | 向某溶液中加入 | 該溶液中一定含有 |
B | 向某溶液中加入稀鹽酸,有無色氣體產生 | 該溶液中一定含有 |
C | 向某溶液中加入 | 該溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液變為紅色 | 該溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化氫直接氧化法制氯氣的反應是4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。剛性容器中,進料濃度比c(HCl):c(O2)分別等于1:1、4:1、7:1時,HCl平衡轉化率隨溫度變化的關系如圖所示。下列說法不正確的是( )
2Cl2(g)+2H2O(g)。剛性容器中,進料濃度比c(HCl):c(O2)分別等于1:1、4:1、7:1時,HCl平衡轉化率隨溫度變化的關系如圖所示。下列說法不正確的是( )
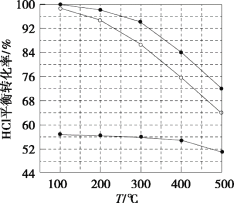
A.K(300℃)>K(400℃)
B.增加反應的壓強和及時分離出氯氣都可以提高氯化氫的轉化率
C.當c(HCl):c(O2)進料比過低時,HCl的轉化率較低,且不利于分離O2和Cl2
D.若HCl的初始濃度為c,進料比為1:1時,K(500℃)=![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廢水脫氮工藝有一種方法是在廢水中加入過量NaClO 使![]() 完全轉化為N2,該反應可表示為2
完全轉化為N2,該反應可表示為2![]() +3ClO-=N2↑+3Cl-+2H++3H2O。下列說法不正確的是( )
+3ClO-=N2↑+3Cl-+2H++3H2O。下列說法不正確的是( )
A.反應中氮元素被氧化,氯元素被還原B.還原性:![]() >Cl-
>Cl-
C.隨反應進行,溶液pH減小D.經此法處理過的廢水可以直接排放
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是重要的化工原料,可用于制備丙烯、氫氣等。
(1)MTO法由甲醇制備丙烯時的反應原理是:甲醇先脫水生成二甲醚,然后二甲醚與甲醇的平衡混合物脫水轉化為含丙烯較多的低聚烯烴。某溫度下,在密閉容器中加入CH3OH氣體,發生脫水反應:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段時間后測得各組分的濃度如表所示。
CH3OCH3(g)+H2O(g),一段時間后測得各組分的濃度如表所示。
物質 | CH3OH | CH3OCH3 | H2O |
5min濃度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min濃度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min濃度(molL-1) | 0.04 | 0.8 | 0.8 |
該溫度下,反應的平衡常數數值是___,CH3OH的平衡轉化率是___。
(2)利用甲醇水蒸氣重整制氫法是獲得氫氣的重要方法。反應原理如下:
反應i(主反應):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反應ii(副反應):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①溫度高于300℃則會同時發生CH3OH轉化為CO和H2的副反應,該反應的熱化學方程式是___。
②反應中,經常使用催化劑提高化學反應速率,但催化劑對反應具有選擇性。一定條件下,測得CH3OH轉化率及CO、CO2選擇性隨溫度變化情況分別如圖所示(CO、CO2的選擇性:轉化的CH3OH中生成CO、CO2的百分比)。

從圖中可知,反應的適宜溫度為___,隨著溫度的升高,催化劑對___(填“反應i”或“反應ii”)的選擇性越低。
③TiO2納米電極電化學還原法可將副產物CO2在酸性水溶液中電解生成甲醇,生成甲醇的電極反應式是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一固體混合物,可能由K2CO3、NaNO2、FeCl3、KClO3、AgNO3混合而成,為檢驗它的成分,做了如下實驗:取固體加入足量的稀硝酸中,攪拌充分反應,得到無色透明溶液,同時有黃綠色氣體和白色沉淀生成![]() 已知NaNO2不能被稀硝酸氧化)。根據以上實驗現象,你認為以下判斷正確的是
已知NaNO2不能被稀硝酸氧化)。根據以上實驗現象,你認為以下判斷正確的是
A.一定含有KClO3、AgNO3、NaNO2,不能肯定是否含有氯化鐵
B.一定含有KClO3,且在反應過程中被還原生成了兩種還原產物
C.另取適量固體加水溶解,若出現白色沉淀,即可證明K2CO3的存在
D.將反應產生的氣體通入少量澄清石灰水,若有無沉淀出現,即可證明K2CO3不存在
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com