
【題目】用原電池原理可以除去酸性廢水中的三氯乙烯和![]() ,其原理如圖所示(導電殼內部為納米鐵)。下列說法正確的是
,其原理如圖所示(導電殼內部為納米鐵)。下列說法正確的是
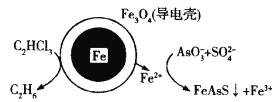
A.納米鐵發生還原反應
B.正極電極反應式:C2HCl3+5H++8e-=C2H6+3Cl-
C.導電殼上電極反應式:![]() +
+![]() +14Fe2++14H+=FeAsS↓+13Fe3++7H2O
+14Fe2++14H+=FeAsS↓+13Fe3++7H2O
D.當電路中有0.4 mol電子轉移時,就會有11.2 L乙烷生成
【答案】B
【解析】
A.據圖可知納米鐵生成Fe2+,化合價升高,發生氧化反應,故A錯誤;
B.原電池正極得電子發生還原反應,據圖可知在酸性條件下,正極上C2HCl3被還原為乙烷,則電極反應式為:C2HCl3+5H++8e-=C2H6+3C1-,故B正確;
C.據示意圖可判斷亞鐵離子還原AsO3-,但該反應并不是發生在導電殼上,而是發生在含SO42-的酸性溶液中,導電殼上的反應為鐵被氧化成亞鐵離子,故C錯誤;
D.根據電極反應式為:C2HCl3+5H++8e-=C2H6+3C1-,當電路中有0.4mol電子轉移時,就會有0.5mol乙烷生成,但未指明溫度和壓強,不能確定氣體的體積,故D錯誤;
故答案為B。


科目:高中化學 來源: 題型:
【題目】700℃時,向容積為2L的密閉容器中充入一定量的CO和H2O,發生反應:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反應過程中測定的部分數據見下表(表中t2>t1)
CO2(g)+H2(g),反應過程中測定的部分數據見下表(表中t2>t1)
反應時間/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列說法正確的是( )
A.反應在t1min內的平均速率為v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他條件不變,起始時向容器中充入0.60mol CO和1.20mol H2O,達到平衡時n(CO2)=0.40mol
C.保持其他條件不變,向平衡體系中再通入0.20mol H2O,與原平衡相比,達到新平衡時CO轉化率增大,H2O的體積分數減小
D.若溫度升高至800℃,上述反應平衡常數為0.64,則正反應為吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 在元素周期表2、3、4周期中,元素
在元素周期表2、3、4周期中,元素![]() 、
、![]() 、
、![]() 、
、![]() 與元素
與元素![]() 相鄰,已知:
相鄰,已知:![]() 元素為磷元素;
元素為磷元素;![]() 的氯化物分子呈正四面體結構:
的氯化物分子呈正四面體結構:![]() 與
與![]() 可以形成一種高溫結構陶瓷;
可以形成一種高溫結構陶瓷;![]() 的最高化合價氧化物的水化物是強酸。下列選項錯誤的是( )
的最高化合價氧化物的水化物是強酸。下列選項錯誤的是( )
A.![]() 的氧化物的晶體類型是共價晶體
的氧化物的晶體類型是共價晶體
B.![]() 的單質在空氣中廣泛存在
的單質在空氣中廣泛存在
C.![]() 和
和![]() 形成的化合物中,
形成的化合物中,![]() 可以呈現的最高化合價是
可以呈現的最高化合價是![]() 價
價
D.![]() 、
、![]() 、
、![]() 的氫化物中,沸點最低的是
的氫化物中,沸點最低的是![]() 的氫化物
的氫化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是一種優良的消毒劑,濃度過高時易發生分解,為了運輸和貯存便利常將其制成
是一種優良的消毒劑,濃度過高時易發生分解,為了運輸和貯存便利常將其制成![]() 固體,模擬工業上用過氧化氫法制備
固體,模擬工業上用過氧化氫法制備![]() 固體的實驗裝置如圖所示。
固體的實驗裝置如圖所示。
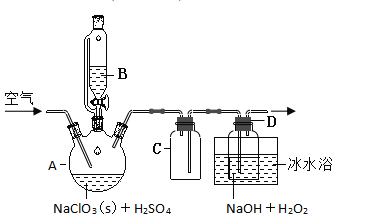
已知:![]() 熔點-59℃、沸點11℃、
熔點-59℃、沸點11℃、![]() 沸點150℃
沸點150℃
![]() 中的化學方程式:
中的化學方程式:![]()
(1)![]() 放入儀器
放入儀器![]() 中,儀器
中,儀器![]() 中的藥品是__________(寫化學式)。如果儀器
中的藥品是__________(寫化學式)。如果儀器![]() 改成分液漏斗,實驗過程中可能會出現的實驗現象__________。
改成分液漏斗,實驗過程中可能會出現的實驗現象__________。
(2)![]() 裝置有明顯缺陷,請繪出合理的裝置圖(標明氣流方向)__________。
裝置有明顯缺陷,請繪出合理的裝置圖(標明氣流方向)__________。
(3)向![]() 裝置中通入空氣,其作用是趕出
裝置中通入空氣,其作用是趕出![]() ,然后通過
,然后通過![]() 再到
再到![]() 中反應。通空氣不能過快的原因是__________,通空氣也不能過慢原因是__________。
中反應。通空氣不能過快的原因是__________,通空氣也不能過慢原因是__________。
(4)冰水浴冷卻的目的是__________。
a.降低![]() 的溶解度 b.減少
的溶解度 b.減少![]() 的分解 c.使
的分解 c.使![]() 變為液態 d.加快反應速率
變為液態 d.加快反應速率
(5)寫出![]() 中發生反應的化學方程式__________,
中發生反應的化學方程式__________,![]() 在反應起到__________作用。假設在反應中消耗掉
在反應起到__________作用。假設在反應中消耗掉![]() 則有__________
則有__________![]() 電子轉移。
電子轉移。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物 A、B、C、D、E 的衍變關系如下所示。其中,A 是糧食發酵的產物,D 是高分子化合物,E 具有水果香味。
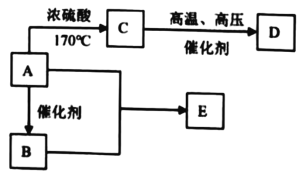
請回答下列問題:
(1)A 的名稱是______,含有的官能團名稱是______。
(2)寫出 A 和 B 反應生成 E 的化學方程式______,該反應的類型為______。
(3)D 的結構簡式為______。
(4)寫出把 C 通入溴水中的現象______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲用98%的濃硫酸(密度為1.84g·cm-3)配制成濃度為0.5mol·L-1的稀硫酸480mL。
(1)選用的主要儀器有:量筒、玻璃棒、膠頭滴管、燒杯、_______。
(2)請將下列各操作,按正確的序號填在橫線上。
A.用量筒量取濃H2SO4 B.反復顛倒搖勻
C.用膠頭滴管加蒸餾水至刻度線 D.洗凈所用儀器
E.稀釋濃H2SO4 F.將溶液轉入容量瓶
其操作正確的順序依次為_______。
(3)簡要回答下列問題:
①所需濃硫酸的體積為_______mL。
②如果實驗室有15mL、20mL、50mL的量筒應選用_____mL的量筒最好,量取時發現量筒不干凈用水洗凈后直接量取將使濃度____(“偏高”、“偏低”、“無影響”)。
③將濃硫酸沿燒杯內壁慢慢注入盛水的燒杯中,并用玻璃棒不斷攪拌的目的是_____,若攪拌過程中有液體濺出結果會使濃度偏______。
④在轉入容量瓶前燒杯中液體應______,否則會使濃度偏_______;并洗滌燒杯和玻璃棒2~3次,洗滌液也要轉入容量瓶,否則會使濃度_______。
⑤定容時必須使溶液凹液面與刻度線相切,若俯視會使濃度_____;仰視則使濃度______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
①將![]() 與NaOH的醇溶液共熱制備CH3-CH=CH2
與NaOH的醇溶液共熱制備CH3-CH=CH2
②乙酰水楊酸![]() 與適量NaOH溶液反應制備
與適量NaOH溶液反應制備![]()
③從煤焦油中分離出苯、甲苯、二甲苯等有機物的過程為物理變化
④實驗時手指不小心沾上苯酚,立即用70°C以上的熱水清洗
A.只有①正確B.只有②正確C.只有③正確D.只有④正確
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今有室溫下四種溶液,有關敘述不正確的是
序號 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氫氧化鈉溶液 | 醋酸 | 鹽酸 |
A. ③④中分別加入適量的醋酸鈉晶體后,兩溶液的pH均增大
B. ②③兩溶液等體積混合,所得溶液中c(H+)>c(OH-)
C. 分別加水稀釋10倍,四種溶液的pH①>②>④>③
D. V1L④與V2L①溶液混合后,若混合后溶液pH=7,則V1<V2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤燃燒排放的煙氣含有SO2和NOx,形成酸雨、污染大氣,采用NaClO2溶液作為吸收劑可同時對煙氣進行脫硫、脫硝。回答下列問題:
(1)NaClO2的化學名稱為__________。
(2)在鼓泡反應器中通入含有SO2和NO的煙氣,反應溫度323 K,NaClO2溶液濃度為5×10-3 mol/L。反應一段時間后溶液中離子濃度的分析結果如下表。
離子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①出NaClO2溶液脫硝過程中主要反應的離子方程式__________________________。增加壓強,NO的轉化率________________(填“提高”“不變”或“降低”)。
②著吸收反應的進行,吸收劑溶液的pH逐漸____________(填“增大”“不變”或“減小”)。
③由實驗結果可知,脫硫反應速率______________反應速率(填“大于”或“小于”)。原因是除了SO2和NO在煙氣中的初始濃度不同,還可能是____________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到較好的煙氣脫硫效果。
①從化學平衡原理分析,Ca(ClO)2相比NaClO具有的優點是______________。
②知下列反應:
SO2(g)+2OH-(aq) =SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq)ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
則反應SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com