
【題目】利用化學原理可以對工廠排放的廢水、廢渣等進行有效檢測與合理處理。某工廠對制革工業污泥中Cr(Ⅲ)的處理工藝流程如下:
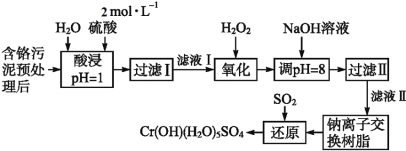
已知:①硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常溫下,部分陽離子以氫氧化物形式沉淀時溶液的pH如下:
陽離子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全時的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)實驗室用18.4 mol·L-1的濃硫酸配制480 mL 2 mol·L-1的硫酸,需量取濃硫酸_________mL;配制時所用玻璃儀器除量筒、膠頭滴管、燒杯和玻璃棒外,還需__________________________。
(2)H2O2的作用是將濾液Ⅰ中的Cr3+轉化為Cr2O72-,寫出此反應的離子方程式:__________。
(3)加入NaOH溶液使溶液呈堿性,既可以除去某些雜質離子,同時又可以將Cr2O72-轉化為CrO42-,寫出該反應的離子方程式__________________。
(4)鈉離子交換樹脂的反應原理為:Mn+ + n NaR = MRn + n Na+,則利用鈉離子交換樹脂可除去濾液Ⅱ中的金屬陽離子有__________________。
(5)寫出上述流程中用SO2進行還原時發生反應的離子方程式:_________________。
(6)沉淀滴定法是測定粒子濃度的方法之一,為了測定某廢水中SCN-濃度,可用標準AgNO3溶液滴定待測液,已知:
銀鹽性質 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
顏色 | 白 | 黃 | 白 | 磚紅 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定時可選為滴定指示劑的是_________(選填編號),滴定終點現象是:________。
A.NaCl B.K2CrO4 C.KI D.NaCN
【答案】54.3 500mL容量瓶 2Cr3++3H2O2+H2O=Cr2O72-+8H+ Cr2O72-+2 OH- = 2CrO42-+H2O Mg2+、Ca2+ 2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH- B 當滴入最后一滴標準液時,沉淀由白色變為磚紅色,且半分鐘內沉淀顏色不再改變
【解析】
流程硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入H2O2的作用是將濾液Ⅰ中的Cr3+轉化為Cr2O72-,調節pH=8是為了讓Fe3+、Al3+轉化為氫氧化物沉淀而除去,同時Cr2O72-轉化為CrO42-,過濾后,濾液Ⅱ通過鈉離子交換樹脂是為了除掉Ca2+和Mg2+,通入二氧化硫發生氧化還原反應得到Cr(OH)(H2O)5SO4;
(1)配置一定濃度的溶液要注意用500mL容量瓶,根據步驟確定所需儀器;
(2)三步法配平離子方程式①化合價升降相等配平化合價變化的元素②根據左右兩邊電荷守恒確定氫離子系數③根據左右兩邊原子守恒確定水的系數;
(3)利用電荷守恒和原子守恒書寫離子方程式;
(4)學會知識遷移,聯想硬水的軟化就可確定Ca2+和Mg2+,或者根據陽離子互換原則確定;
(5)三步法配平離子方程式①化合價升降相等配平化合價變化的元素②根據左右兩邊電荷守恒確定氫氧根離子系數③根據左右兩邊原子守恒確定水的系數;
(6)指示劑選擇原則①顏色變化明顯②Ksp略微大于AgSCN。
(1)根據C1V1= C2V2列等式,18.4×V1×10-3=2×500×10-3,V1=54.3mL;配制時所用玻璃儀器還需500mL容量瓶;
正確答案:54.3 500mL容量瓶。
(2)三步法配平離子方程式①化合價升降相等配平化合價變化的元素②根據左右兩邊電荷守恒確定氫離子系數③根據左右兩邊原子守恒確定水的系數;離子方程式為2Cr3++3H2O2+H2O=Cr2O72-+8H+;
正確答案:2Cr3++3H2O2+H2O=Cr2O72-+8H+。
(3)利用電荷守恒和原子守恒書寫離子方程式Cr2O72-+2OH- = 2CrO42-+H2O;
正確答案:Cr2O72-+2 OH- = 2CrO42-+H2O。
(4)根據陽離子互換原則確定,利用鈉離子交換樹脂可除去濾液Ⅱ中的金屬陽離子有Mg2+、Ca2+;
正確答案:Mg2+、Ca2+。
(5)三步法配平離子方程式①化合價升降相等配平化合價變化的元素②根據左右兩邊電荷守恒確定氫氧根離子系數③根據左右兩邊原子守恒確定水的系數;得2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-;
正確答案:2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-。
(6)指示劑選擇原則①顏色變化明顯②Ksp略微大于AgSCN,確定K2CrO4作為指示劑,滴定終點現象是當滴入最后一滴標準液時,沉淀由白色變為磚紅色,且半分鐘內沉淀顏色不再改變;
正確答案:B 當滴入最后一滴標準液時,沉淀由白色變為磚紅色,且半分鐘內沉淀顏色不再改變。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 化合物 的分子式為C13H9O4N2
的分子式為C13H9O4N2
B. 在堿性條件下,CH3CO18OC2H5的水解產物是CH3COOH和C2H![]() OH
OH
C. 在一定條件下,乙酸、氨基乙酸、蛋白質均能與NaOH發生反應
D. 甲苯苯環上的一個氫原子被—C3H6Cl取代,形成的同分異構體有9種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O![]() 2CrO42-(黃色)+2H+。用K2Cr2O7溶液進行下列實驗:
2CrO42-(黃色)+2H+。用K2Cr2O7溶液進行下列實驗:

(1)向K2Cr2O7溶液中加入30% NaOH溶液,溶液呈________色,因為________________。
(2)若向已加入NaOH溶液的(1)中再加入過量稀硫酸,則溶液呈________色,因為____________________________________________________。
(3)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4為黃色沉淀),則平衡向著_________方向移動,溶液顏色變化為____________。
(4)對比②和④可得出的結論是______________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物F( )為一種高分子樹脂,其合成路線如下:
)為一種高分子樹脂,其合成路線如下:

已知:①A為苯甲醛的同系物,分子中無甲基,其相對分子質量為134;
②
請回答下列問題:
(1)X的化學名稱是_________________。
(2)E生成F的反應類型為_________________。
(3)D的結構簡式為_________________。
(4)由B生成C的化學方程式為_________________。
(5)芳香族化合物Y是D的同系物,Y的同分異構體能與飽和Na2CO3溶液反應放出氣體,分子中只有1個側鏈,核磁共振氫普顯示有5種不同化學環境的氫,峰值面積比為6:2:2:1:1。寫出兩種符合要求的Y的結構簡式___________、__________。
(6)寫出以甲醛、丙醛和乙二醇為主要原料合成軟質隱形眼鏡高分子材料—聚甲基丙烯酸羥乙酯( )的合成路線(無機試劑自選):_________________。
)的合成路線(無機試劑自選):_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于葡萄糖與蔗糖的說法錯誤的是( )。
A.二者的分子式不同,但所含化學元素相同
B.蔗糖能水解,葡萄糖不能水解
C.二者互為同分異構體
D.葡萄糖是單糖,能發生銀鏡反應,蔗糖是雙糖,不能發生銀鏡反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為測定某硫酸銅樣品中硫酸銅的含量(雜質不溶于水,不含銅元素,不與其他物質發生反應),進行了如圖實驗:

(1)上述實驗過程中發生反應的化學方程式為______。
(2)根據已知條件列出求解C燒杯中參加反應的硫酸銅質量(X)的比例式___。
(3)配制上述實驗所用的氫氧化鉀溶液,需要質量分數為40%的氫氧化鉀溶液的質量為___。
(4)樣品中硫酸銅的質量分數為___。
(5)D燒杯溶液中溶質的質量分數為____。
(6)若用濕法冶金的方法冶煉出100kg含雜質4%的銅,需要這種硫酸銅的質量為多少?(寫出計算過程)____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知電導率越大導電能力越強。常溫下用0.100 mol·L-1NaOH溶液分別滴定10.00mL濃度均為0.100 mol·L-1的鹽酸和醋酸溶液,測得滴定過程中溶液的電導率如圖所示。下列說法正確的是

A. 曲線①代表滴定鹽酸的曲線
B. 滴定醋酸的過程應該選擇甲基橙作為指示劑
C. a、b、c三點溶液中水的電離程度:c>a>b
D. b點溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.100mol·L-1的NaOH溶液分別滴定同濃度、體積均為20.00mL的鹽酸和醋酸溶液(用HA表示酸),得到2條滴定曲線,如圖所示。
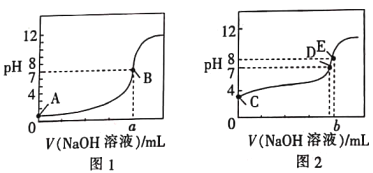
下列說法正確的是
A. 滴定醋酸的曲線是圖1
B. 由圖分析可得b>a=20
C. D點對應的溶液中:c(Na+)=c(A-)
D. 根據E點可計算得K(HA)=[0.05+(10-6-10-8)]×10-8/(10-6-10-8)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com