
在一體積可變的密閉容器中,加入一定量的X、Y,發生反應mX(g) nY(g) ΔH=QkJ/mol。反應達到平衡時,Y的物質的量濃度與溫度、氣體體積的關系如下表所示,下列說法正確的是
nY(g) ΔH=QkJ/mol。反應達到平衡時,Y的物質的量濃度與溫度、氣體體積的關系如下表所示,下列說法正確的是
| 容器體積/L c(Y)/mol/L 溫度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:單選題
對于可逆反應2HI(g)  I2(g)+H2(g),下列敘述能夠說明已達到平衡狀態的是
I2(g)+H2(g),下列敘述能夠說明已達到平衡狀態的是
| A.各物質的量的濃度比2 : 1 : 1 |
| B.容器內的總壓不隨時間變化 |
| C.斷裂2 mol H-I鍵的同時生成1 mol I-I鍵 |
| D.混合氣體的顏色不再變化時 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將等質量的兩份足量的鋅粉a、b分別加入到等量的稀硫酸,同時向a中加少量CuSO4溶液,下圖中產生H2的體積V(L)與時間t(min)的關系,其中正確的是( )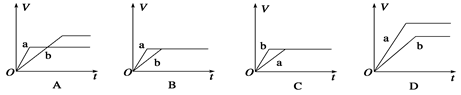
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在恒溫、恒容的條件下,有反應2A(g)+2B(g)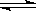 C(g)+3D(g),現從兩條途徑分別建立平衡。途徑Ⅰ:A、B的起始濃度均為2mol/L;途徑Ⅱ:C、D的起始濃度分別為2 mol/L和6mol/L。則以下敘述不正確的是
C(g)+3D(g),現從兩條途徑分別建立平衡。途徑Ⅰ:A、B的起始濃度均為2mol/L;途徑Ⅱ:C、D的起始濃度分別為2 mol/L和6mol/L。則以下敘述不正確的是
A.兩途徑最終達到平衡時,體系內混合氣的平均相對分子質量不同
B.兩途徑最終達到平衡時,體系內混合氣的百分組成相同
C.達平衡時,途徑Ⅰ的反應速率v(A)小于途徑Ⅱ的反應速率v(A)
D.達平衡時,途徑Ⅰ所得混合氣的密度為途徑Ⅱ所得混合氣密度的1/2
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列各表述與示意圖一致的是
A.圖①表示N2O4(g) 2NO2(g) ΔH>0,N2O4轉化率隨溫度、時間的變化 2NO2(g) ΔH>0,N2O4轉化率隨溫度、時間的變化 |
B.圖②中曲線表示反應2SO2(g)+O2(g) 2SO3(g) ΔH<0,正、逆反應的平衡常數K隨溫度的變化 2SO3(g) ΔH<0,正、逆反應的平衡常數K隨溫度的變化 |
| C.圖③表示10 mL0.01 mol/LKMnO4酸性溶液與過量0.1mol/LH2C2O4溶液混合時,n(Mn2+)隨時間的變化 |
| D.圖④中a、b曲線分別表示反應CH2=CH2(g)+H2(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
向一恒容密閉容器中充入2 mol SO2和1mol O2,在一定條件下發生反應:
 ,下列有關說法正確的是( )
,下列有關說法正確的是( )
| A.達到化學平衡時,正反應和逆反應的速率都為零 |
| B.當O2的濃度不變時,反應達到平衡狀態 |
| C.當單位時間消耗a mol O2,同時消耗2a mol SO2時,反應達到平衡狀態 |
| D.當SO2、O2、SO3的分子數比為2:1:2,反應達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在溫度、容積相同的三個密閉容器中發生反應N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下:
| 容器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 體系壓強 | P1 | P2 | P3 |
| 反應物轉化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
實驗室用鋅粒與VmL濃度為10%的稀硫酸反應制取氫氣,若向反應混合物中加入下列物質,關于反應速率v說法正確的是
| A.少量Na2SO4固體,v(H2)減小 | B.VmLBaCl2溶液,v(H2)不變 |
| C.加入細小的碳粒,v(H2)增大 | D.加入NH4HSO4固體,v(H2)不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定溫度下,在2L密閉容器中發生下列反應:4NO2(g)+O2(g) 2N2O5(g);已知該反應的平衡常數:
2N2O5(g);已知該反應的平衡常數: >
> ,且體系中
,且體系中 (單位:mol)隨時間變化如下表:
(單位:mol)隨時間變化如下表:
| 時間(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com