
【題目】以軟錳礦粉(主要含有MnO2,還含有少量的Fe2O3、Al2O3等雜質)為原料制備高純MnO2的流程如下圖所示:
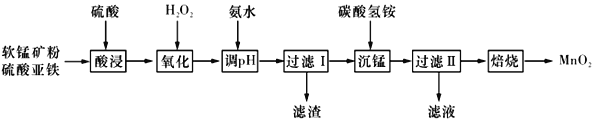
已知:①常溫下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常溫下,氫氧化物沉淀的條件:Al3+、Fe3+完全沉淀的pH分別為4.6、3.4;Mn2+開始沉淀的pH為8.1。
③常溫下,當溶液中金屬離子物質的量濃度小于或等于1×10-5mol·L-l時,可視為該金屬離子已被沉淀完全。
(1)“酸浸”過程中不能用濃鹽酸替代硫酸,原因是_____________________。“酸浸”時加入一定量的硫酸,硫酸不能過多或過少。“硫酸”過多造成氨的損失;硫酸過少時,“酸浸”時會有紅褐色渣出現,原因是___________________________________。
(2)加入氨水應調節pH的范圍為______,當Fe3+恰好沉淀完全時,c(Al3+)=________mol·L-l。
(3)“過濾”所得濾渣為MnCO3,濾液中溶質的主要成分是____________(填化學式),寫出其陽離子的電子式:_______________________________。
(4)加入碳酸氫銨產生沉淀的過程稱為“沉錳”。
①“沉錳”過程中放出CO2,反哥應的離子方程式為_______________________________。
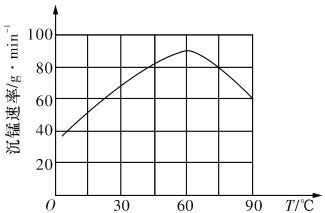
②“沉錳”過程中沉錳速率與溫度的關系如圖所示。當溫度高于60℃時,沉錳速率隨著溫度升高而減慢的原因可能是_______________________________。
【答案】 二氧化錳會氧化濃鹽酸 生成的Fe3+水解得到Fe(OH)3沉淀 4.6~8.1 0.05 (NH4)2SO4 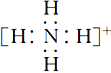 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 溫度過高時碳酸氫銨的分解速率顯著加快,沉錳速率隨碳酸氫銨濃度的減小而減慢
Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 溫度過高時碳酸氫銨的分解速率顯著加快,沉錳速率隨碳酸氫銨濃度的減小而減慢
【解析】(1)“酸浸”過程中不能用濃鹽酸替代硫酸,原因是二氧化錳會氧化濃鹽酸。“酸浸”時加入一定量的硫酸,硫酸不能過多或過少。“硫酸”過多造成氨的損失;硫酸過少時,“酸浸”時會有紅褐色渣出現,原因是生成的Fe3+水解得到Fe(OH)3沉淀。
(2)由題中信息可知,Al3+、Fe3+完全沉淀的pH分別為4.6、3.4,Mn2+開始沉淀的pH為8.1。所以,加入氨水應調節pH的范圍為4.6~8.1,當Fe3+恰好沉淀完全時,的物質的量濃度最大值為1×10-5mol·L-l,此時溶液中c(OH-)的最小值為![]() mol/L,c(Al3+)=
mol/L,c(Al3+)=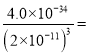 0.05mol·L-l。
0.05mol·L-l。
(3)“過濾”所得濾渣為MnCO3,濾液中溶質的主要成分是(NH4)2SO4,其陽離子的電子式為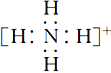 。
。
(4)①“沉錳”過程中放出CO2,反哥應的離子方程式為Mn2++2HCO3-=MnCO3↓+CO2↑+H2O。
②當溫度高于60℃時,沉錳速率隨著溫度升高而減慢的原因可能是:溫度過高時碳酸氫銨的分解速率顯著加快,沉錳速率隨碳酸氫銨濃度的減小而減慢。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】碳是一種常見的元素,它以多種形式廣泛存在于自然界之中。
(1)星際空間存在多種有機分子和無機分子,多數都含有碳元素,C2是一種星際分子,C2和C60互為_______________。
(2)CO2是碳元素重要的氧化物,回答下列有關問題:
①利用CO2與Na2O2反應,可向呼吸面具中提供氧氣,其反應方程式為_________________。
②工業上可由CO2和NH3在一定條件下合成尿素,反應方程式為2NH3+CO2![]() CO(NH2)2+H2O當
CO(NH2)2+H2O當![]() 時,CO2的轉化率隨時間的變化關系如圖所示.
時,CO2的轉化率隨時間的變化關系如圖所示.
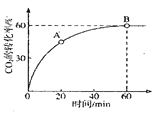
A點的逆反應速率![]() __________B點的正反應速率
__________B點的正反應速率![]() (填“大于“小于”或“等于”),NH3的平衡轉化率為____________。
(填“大于“小于”或“等于”),NH3的平衡轉化率為____________。
③隨著對環境問題認識的深入,CO2的轉化捕獲問題已成為科研熱點之一,以附著納米銀的惰性電極作陰極,可電解CO2轉化為CO,裝置示意圖如下:
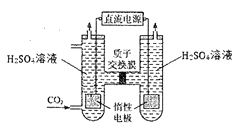
寫出通CO2側電極反應式_________________。
④CO2可用于生產碳酸飲料。苯甲酸鈉(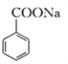 可寫為C6H5COONa)也是某些飲料的添加劑,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力顯著高于苯甲酸鈉。在生產的某飲料的過程中,除了添加苯甲酸鈉外,還需加壓充入CO2氣體。若忽略碳酸的二級電離,試寫出碳酸與苯甲酸鈉反應的離子方程式__________________,經計算該反應的化學平衡常數為______________,加壓充入CO2后,該飲料的抑菌能力明顯增強,結合上述離子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
可寫為C6H5COONa)也是某些飲料的添加劑,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力顯著高于苯甲酸鈉。在生產的某飲料的過程中,除了添加苯甲酸鈉外,還需加壓充入CO2氣體。若忽略碳酸的二級電離,試寫出碳酸與苯甲酸鈉反應的離子方程式__________________,經計算該反應的化學平衡常數為______________,加壓充入CO2后,該飲料的抑菌能力明顯增強,結合上述離子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金剛石和石墨均為碳的同素異形體,氧氣不足時它們燃燒生成一氧化碳,充分燃燒時生成二氧化碳,反應中放出的熱量如圖所示。

(1)寫出石墨轉化為金剛石的熱化學方程式____________________________________。
(2)寫出石墨和二氧化碳反應生成一氧化碳的熱化學方程式_____________________。
(3)科學家首次用X射線激光技術觀察到CO與O在催化劑表面形成化學鍵的過程。反應過程的示意圖如下:
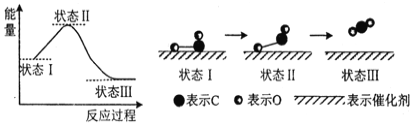
①判斷CO和O生成CO2是放熱反應的依據是__________________。
②寫出CO2的電子式___________________,CO2含有的化學鍵類型是(若含共價鍵,請標明極性或非極性)______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1mol Na轉變為Na+時失去的電子數為( )
A.3.01×1023
B.6.02×10﹣23
C.1.204×1023
D.6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:(1)環己烯可以通過丁二烯與乙烯發生環化加成反應得到

(2)實驗證明,下列反應中反應物分子的環外雙鍵比環內雙鍵更容易被氧化:
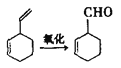
(3)R-CHO +H2→ R-CH2OH現僅以丁二烯為有機原料,無機試劑任選,按下列途徑合成甲基環己烷:
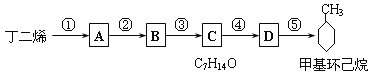
請按要求填空:
(1)A的結構簡式是___________________;B的結構簡式是______________ 。
(2)寫出下列反應的化學方程式和反應類型:
反應④ ____________________________ ,反應類型______________。
反應⑤_____________________________ ,反應類型 __________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列化合物的結構分析回答:
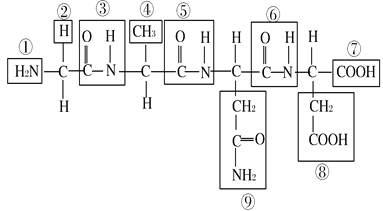
(1) 該化合物中,①表示 ,⑦表示 。
(2) 該化合物由 個氨基酸失去 個水分子而形成,這種反應叫做 。
(3) 該化合物中的氨基酸種類不同,是由 決定的,其編號是 。
(4) 該化合物稱為 ,含 個肽鍵,編號是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A(C2H4)是基本的有機化工原料。用A和常見的有機物可合成一種醚類香料和一種縮醛類香料,具體合成路線如圖所示(部分反應條件略去):

已知:

回答下列問題:
(1)B的分子式是___________,C中含有的官能團名稱是 ____________。
(2)若D為單取代芳香族化合物且能與金屬鈉反應;每個D分子中只含有1個氧原子,D中氧元素的質量分數約為13.1%,則D的結構簡式為___________,⑥的反應類型是________________。
(3)據報道,反應⑦在微波輻射下,以NaHSO4·H2O為催化劑進行,請寫出此反應的化學方程式:____________________________________。
(4)請寫出滿足下列條件的苯乙醛的所有同分異構體的結構簡式:___________________。
i .含有苯環和![]() 結構
結構
ii.核磁共振氫譜有4組峰,且峰面積之比為3∶2∶2∶1
(5)若化合物E為苯甲醚的同系物,且相對分子質量比苯甲醚大14,則能使FeCl3溶液顯色的E的所有同分異構體共有(不考慮立體異構)________________種。
(6)參照 的合成路線,寫出由2-氯丙烷和必要的無機試劑制備
的合成路線,寫出由2-氯丙烷和必要的無機試劑制備 的合成流程圖:_______________________________________
的合成流程圖:_______________________________________
合成流程圖示例如下:CH2 = CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com