
【題目】某學生課外活動小組利用下圖所示裝置分別做如下實驗:
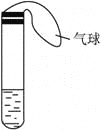
(1)在試管中注入某紅色溶液,加熱試管,溶液顏色逐漸變淺,冷卻后恢復紅色,則原溶液可能是________溶液;加熱時溶液由紅色逐漸變淺的原因是________________。
(2)在試管中注入某無色溶液,加熱試管,溶液變?yōu)榧t色,冷卻后恢復無色,則此溶液可能是________溶液;加熱時溶液由無色變?yōu)榧t色的原因是________________。
【答案】溶液NH3的酚酞 加熱時NH3·H2O分解,溶液的堿性減弱,溶液的顏色逐漸變淺 溶有SO2的品紅 SO2具有漂白性,SO2與品紅溶液化合成不穩(wěn)定的無色物質(zhì),加熱時該不穩(wěn)定的無色物質(zhì)受熱分解,SO2逸出,品紅溶液又恢復紅色
【解析】
(1)紅色溶液加熱后顏色變淺,說明該溶液加熱時易分解,該溶液可能是溶有NH3的酚酞溶液 ,NH3的水溶液呈堿性,使酚酞變紅,加熱時NH3·H2O分解,溶液的堿性減弱,所以溶液的顏色變淺,方程式為:NH3·H2O ![]() NH3↑+ H2O;
NH3↑+ H2O;
(2)某無色溶液,加熱試管,溶液變?yōu)榧t色,冷卻后恢復無色,說明加熱時產(chǎn)生的氣體可以使紅色溶液變?yōu)闊o色,同時生成的無色物質(zhì)不穩(wěn)定,很容易聯(lián)想到SO2的漂白原理,所以無色溶液可能為溶有SO2的品紅溶液,加熱時溶液由無色變?yōu)榧t色的原因是:SO2具有漂白性,SO2與品紅溶液化合成不穩(wěn)定的無色物質(zhì),加熱時該不穩(wěn)定的無色物質(zhì)受熱分解,SO2逸出,品紅溶液又恢復紅色。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】某溫度下,在一體積恒定的密閉容器內(nèi)發(fā)生反應A(s)+2B(g)![]() C(g)+D(g),當下列物理量不再變化時,能夠表明反應已達平衡的是( )
C(g)+D(g),當下列物理量不再變化時,能夠表明反應已達平衡的是( )
A.氣體的壓強B.氣體的總物質(zhì)的量
C.氣體的平均密度D.C和D的物質(zhì)的量比是定值
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】復合氧化鉆![]() 可用于生產(chǎn)合金磁性材料、催化劑等。為充分利用資源,在實驗室中探究采用含鈷廢渣(含
可用于生產(chǎn)合金磁性材料、催化劑等。為充分利用資源,在實驗室中探究采用含鈷廢渣(含![]() 等)來制備復合氧化鈷,具體流程如下:
等)來制備復合氧化鈷,具體流程如下:

回答下列問題:
(1)![]() 的電子式為_______________________。
的電子式為_______________________。
(2)“堿煮水洗”的目的為______________________________________________。
(3)“酸浸”時,![]() 發(fā)生反應的離子方程式為_____________________________________________;濾渣1中主要成分的化學式為_______________________。
發(fā)生反應的離子方程式為_____________________________________________;濾渣1中主要成分的化學式為_______________________。
(4)檢驗“水洗液”中含有![]() 的操作和現(xiàn)象為______________________________________________。上述流程中多次應用過濾操作該操作所用主要玻璃儀器有_____________________。
的操作和現(xiàn)象為______________________________________________。上述流程中多次應用過濾操作該操作所用主要玻璃儀器有_____________________。
(5)下列裝置中,適合進行“焙燒”操作的是_____________________(填選項字母)。
A. B.
B. C.
C. D.
D.
(6)稱量![]() ,充分“焙燒”后得復合氧化鈷
,充分“焙燒”后得復合氧化鈷![]() ,則復合氧化鉆的化學式為________________;“焙燒”過程中生成的氣體能參與大氣循環(huán),則該過程_______________(填“有”或“無”)氧氣參加反應。
,則復合氧化鉆的化學式為________________;“焙燒”過程中生成的氣體能參與大氣循環(huán),則該過程_______________(填“有”或“無”)氧氣參加反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 的捕捉和綜合利用是目前研究的熱點之一。回答下列問題:
的捕捉和綜合利用是目前研究的熱點之一。回答下列問題:
(1)科研工作者發(fā)現(xiàn)一種捕獲二氧化碳生成甲酸的簡單過程如圖所示。
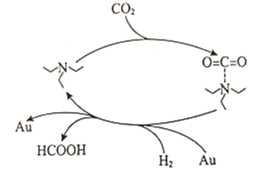
下列說法正確的是__________________(填選項字母)。
A.增大![]() 的物質(zhì)的量可增大
的物質(zhì)的量可增大![]() 的平衡產(chǎn)率
的平衡產(chǎn)率
B.![]() 和
和![]() 均能降低反應的活化能
均能降低反應的活化能
C.上述捕獲過程能有效減少溫室氣體排放
(2)![]() 能用于制備二甲醚
能用于制備二甲醚
I.![]()
II.![]()
III.![]()
①二氧化碳氣體與氫氣生成二甲醚蒸氣和水蒸氣反應的熱化學方程式為______________。
②![]() 時,在恒容密閉容器中發(fā)生反應I時,下列事實能說明該反應達到平衡狀態(tài)的是_____________(填選項字母)。
時,在恒容密閉容器中發(fā)生反應I時,下列事實能說明該反應達到平衡狀態(tài)的是_____________(填選項字母)。
A.氣體的平均相對分子質(zhì)量不再改變
B. ![]() 不再改變
不再改變
C.斷裂![]() 鍵同時斷裂
鍵同時斷裂![]() 鍵
鍵
D.混合氣體的密度不再改變
③![]() 時,向密閉容器中充入一定量
時,向密閉容器中充入一定量![]() ,發(fā)生反應Ⅱ,測得反應前壓強為
,發(fā)生反應Ⅱ,測得反應前壓強為![]() ,
,![]() 恰好達到平衡時,
恰好達到平衡時,![]() 的分壓為
的分壓為![]() ,則
,則![]() 內(nèi)的反應速率
內(nèi)的反應速率![]() _____________(用分壓表示,下同);反應的平衡常數(shù)
_____________(用分壓表示,下同);反應的平衡常數(shù)![]() _____________。
_____________。
④在催化劑條件下,發(fā)生反應![]() 。
。
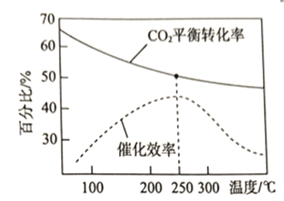
該反應的![]() ___________0(填“>”或“<”);
___________0(填“>”或“<”);![]() 的平衡轉化率和催化劑的催化效率與溫度的關系如圖所示。則將反應溫度選擇為
的平衡轉化率和催化劑的催化效率與溫度的關系如圖所示。則將反應溫度選擇為![]() 的原因為________________________________。
的原因為________________________________。
⑤向某絕熱剛性容器中充入一定量的![]() 和
和![]() ,發(fā)生反應Ⅲ。容器內(nèi)平衡壓強______________________(填“大于”“小于”或“等于”)起始壓強,原因為______________________。
,發(fā)生反應Ⅲ。容器內(nèi)平衡壓強______________________(填“大于”“小于”或“等于”)起始壓強,原因為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫、體積為2L的密閉容器中加入1molCO2和3molH2,發(fā)生如下的反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。可認定該可逆反應在一定條件下已達到化學平衡狀態(tài)的是
CH3OH(g)+H2O(g) △H<0。可認定該可逆反應在一定條件下已達到化學平衡狀態(tài)的是
A. 容器中CO2、H2、CH3OH、H2O的物質(zhì)的量之比為1∶3∶1 ∶1
B. v正(CO2)=v逆(H2O)
C. 容器內(nèi)混合氣體密度保持不變
D. 3molH-H鍵斷裂同時生成3molH-O鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學仿照“噴泉”實驗的原理,在實驗室中做了一個“噴煙”實驗,如圖所示。
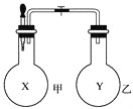
該同學在甲、乙兩個燒瓶中分別充入X、Y兩種無色氣體,在膠頭滴管中盛有含酚酞的氫氧化鈉溶液,實驗時將膠頭滴管內(nèi)的液體擠入甲燒瓶內(nèi),然后打開止水夾,便可看到甲燒瓶中的導管口噴出白色的煙,同時甲燒瓶中的溶液顏色逐漸變淺。若已知X、Y是氯化氫、氨氣、氯氣、氧氣、甲烷、二氧化硫、一氧化氮七種氣體中的兩種,則下列判斷中,正確的是( )
A. X是氨氣,Y是氯化氫 B. X是氯氣,Y是甲烷
C. X是二氧化硫,Y是氧氣 D. X是一氧化氮,Y是氧氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2S與CO2在高溫下發(fā)生反應:H2S(g)+CO2(g)![]() COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在溫度為T1時,將0.10 mol CO2與0.40 mol H2S充入2.5 L的空鋼瓶中,經(jīng)過4 min反應達到平衡,平衡時H2O(g)的物質(zhì)的量分數(shù)為2%,則下列說法不正確的是
COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在溫度為T1時,將0.10 mol CO2與0.40 mol H2S充入2.5 L的空鋼瓶中,經(jīng)過4 min反應達到平衡,平衡時H2O(g)的物質(zhì)的量分數(shù)為2%,則下列說法不正確的是
A.CO2的平衡轉化率α=2.5%
B.0~4 min內(nèi)用H2S表示該反應的速率為0.001 mol·L1·min1
C.上述條件下反應達到平衡時放出的熱量為0.01Q kJ
D.其他條件不變,若該反應在溫度為T2條件下進行,達到平衡所需時間小于4 min,則T1<T2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一恒溫、恒容的密閉容器中存在化學平衡:H2(g)+I2(g) ![]() 2HI(g),已知H2和I2的起始濃度均為0.10molL-1,達到平衡狀態(tài)時HI的濃度為0.16molL-1。若H2和I2的起始濃度均變?yōu)?/span>0.20molL-1,則平衡時H2的濃度為( )
2HI(g),已知H2和I2的起始濃度均為0.10molL-1,達到平衡狀態(tài)時HI的濃度為0.16molL-1。若H2和I2的起始濃度均變?yōu)?/span>0.20molL-1,則平衡時H2的濃度為( )
A. 0.16molL-1 B. 0.08 molL-1 C. 0.04 molL-1 D. 0.02molL-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】P4S3是黃色或淡黃色結晶或粉末,無臭、無味、易燃、有毒,遇潮氣發(fā)生分解,分子結構如圖所示,已知其燃燒熱ΔH=3 677 kJ/mol(P被氧化為P4O10),下列有關P4S3的說法中不正確的是
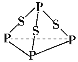
A.分子中磷元素顯+3價
B.分子中每個原子最外層均達到8電子穩(wěn)定結構
C.熱化學方程式為P4S3(s)+8O2(g) ===P4O10(s)+3SO2(g) ΔH=3 677 kJ/mol
D.分子中存在極性鍵與非極性鍵
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com