
【題目】1-溴丁烷(密度1.2758 g/mL)是重要的有機合成中間體及有機溶劑,可以在實驗室里用溴化鈉、濃硫酸和1-丁醇為原料,經過如圖六步制得。
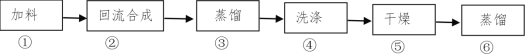
完成下列填空:
(1)通過步驟②獲得粗產品,反應的化學方程式是___。此時產品往往呈紅棕色,原因是____。實驗室里有下列常用試劑,請根據實驗需要為與步驟④相關的(2)(3)小題選擇試劑,并用試劑編號填空:
a.NaOH溶液 b.NaHCO3溶液 c.NaHSO3 溶液 d.NaBr溶液
(2)產品的紅棕色可用___除去(填寫試劑編號),相應的離子方程式為___。
(3)選用濃硫酸洗去未反應的1-丁醇和有機副產物,然后除酸。最適宜的除酸試劑是__(填寫試劑編號)。
(4)用濃硫酸(密度1.84g/mL)洗滌時,采用___(填寫儀器名稱)分離出___(填寫“上”或“下”)層產物。
(5)檢驗產物中含有溴元素的實驗方法是____。
【答案】NaBr+H2SO4(濃)→NaHSO4+HBr、HBr+CH3CH2OH→CH3CH2Br+H2O 濃硫酸具有強氧化性,溴離子具有還原性,部分溴化物被氧化成溴,導致產品呈紅棕色 C Br2+SO32-+H2O→2Br-+2H+ +SO42- b 分液漏斗 上 取樣,加入氫氧化鈉溶液并加熱,用稀硝酸調節到酸性,再滴入硝酸銀溶液,有淡黃色沉淀產生
【解析】
(1)溴化鈉與濃硫酸得到HBr,1-丁醇與HBr發生取代反應生成1-溴丁烷;濃硫酸具有強氧化性,可以將溴離子氧化為溴單質;
(2)強堿容易使1-溴丁烷水解,溴具有強氧化性,可以用還原性的NaHSO3溶液除去;
(3)碳酸氫鈉溶液顯弱堿性,可以除去剩余的硫酸;
(4)濃硫酸與有機物不互溶,采用分液方法分離,濃硫酸的密度比1-溴丁烷大;
(5)先在堿性條件下水解,再用硝酸酸化的硝酸銀溶液檢驗。
(1)溴化鈉與濃硫酸得到HBr,1-丁醇與HBr發生取代反應生成1-溴丁烷,反應方程式為:NaBr+H2SO4(濃)→NaHSO4+HBr、HBr+CH3CH2OH→CH3CH2Br+H2O;濃硫酸有強氧化性,溴離子有還原性,部分溴化物被氧化成溴,導致產品往往呈紅棕色;
(2)強堿容易使1-溴丁烷水解,溴具有強氧化性,可以用還原性的NaHSO3溶液除去,反應離子方程為:Br2+HSO3-+H2O=3H++SO42-+2Br-;
(3)碳酸氫鈉溶液顯弱堿性,最適宜除去剩余的硫酸,氫氧化鈉溶液堿性太強,亞硫酸氫鈉溶液反應會生成二氧化硫氣體,溴化鈉溶液與少量硫酸不反應,故選:b;
(4)濃硫酸與有機物不互溶,采用分液方法分離,需要用分液漏斗分離,濃硫酸的密度比1-溴丁烷大,有機層在上層;
(5)檢驗產物中含有溴元素的實驗方法是:取少量產品樣品,加入NaOH溶液并加熱,用稀硝酸調至酸性,加入硝酸銀溶液,產生淡黃色沉淀。


科目:高中化學 來源: 題型:
【題目】Ⅰ.某微粒的結構示意圖為![]() ,試回答:
,試回答:
(1)當y=8時,該粒子可能是_____、_____(分別寫出一種陽離子和一種陰離子)。
(2)當x-y=10時,該粒子為_______(選填“原子”或“陽離子”、“陰離子”)。
(3)請寫出工業上制取y=7元素對應單質的化學方程式:________________。
Ⅱ.現有 ①BaCl2晶體 ②金剛石 ③碘片 ④干冰 ⑤二氧化硅 ⑥氫氧化鉀 ⑦鈉 七種物質,請按下列要求回答(填序號):
(1)屬于只含離子鍵的離子晶體的是____________(填序號,下同)。
(2)屬于分子晶體的單質是__________。
(3)屬于原子晶體的化合物是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銦產業被稱為“信息時代的朝陽產業”。元素周期表中銦的數據見圖,下列說法完全正確的是
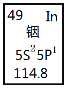
A.銦元素的質量數是114.8
B.銦元素的相對原子質量是115,中子數為66
C.銦元素是一種主族元素,位于第五周期第ⅢA族
D.銦原子最外層有3個能量相同的電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物是藥物生產的中間體,其結構簡式如圖。下列有關敘述正確的是
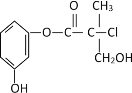
A.該有機物與溴水可發加成反應
B.該有機物與濃硫酸混合共熱可發生消去反應
C.1 mol該有機物與足量NaOH溶液反應最多消耗3molNaOH
D.該有機物經催化氧化后與新制氫氧化銅懸濁液共熱生成磚紅色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵和鋁是兩種重要的金屬,它們的單質及化合物有著各自的性質。在一定溫度下,氧化鐵可以與一氧化碳發生下列反應:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)。
2Fe(s)+3CO2(g)。
(1)①該反應的平衡常數表達式為:K=___。
②該溫度下,在2L盛有Fe2O3粉末的密閉容器中通入CO氣體,10min后,生成了單質鐵11.2g。則10min內CO的平均反應速率為___。
(2)請用上述反應中某種氣體的有關物理量來說明該反應已達到平衡狀態:①___②___。
(3)明礬KAl(SO4)2·12H2O的水溶液呈___性(填”酸性、堿性、中性),溶液中各離子的濃度從大到小的順序為____。
(4)寫出氫氧化鋁在水中發生酸式電離的電離方程式:___,欲使上述體系中Al3+濃度增加,可加入的物質是____。
(5)某些金屬氧化物粉末和Al粉在鎂條的引燃下可以發生鋁熱反應。下列反應速率(v)和溫度(T)的關系示意圖中與鋁熱反應最接近的是____。
a. b.
b. c.
c. d.
d.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定穩定下,在容積不變的密閉容器中,進行如下可逆反應:![]() ,下列能表明該反應已達到平衡狀態的是
,下列能表明該反應已達到平衡狀態的是
①![]()
②![]()
③![]()
④混合氣的密度保持不變
⑤混合氣體的平均摩爾質量不變
A.僅④B.僅④⑤
C.僅①④D.僅③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列結構示意圖,判斷下列說法中正確的是

A. 在NaCl晶體中,距Na+最近的多個Cl-構成正四面體
B. 在CaF2晶體中,Ca2+的配位數為4
C. 在金剛石晶體中,碳原子與碳碳鍵數之比為1:2
D. 該氣態團簇分子的分子式為EF或FE
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置不能達到實驗目的的是
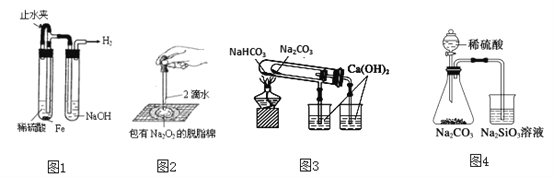
A. 圖1:制備并觀察氫氧化亞鐵
B. 圖2:證明過氧化鈉與水反應放熱
C. 圖3:驗證NaHCO3和Na2CO3的熱穩定性
D. 圖4:驗證酸性強弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷化氫(![]() )、氧硫化碳(COS)均可作儲糧害蟲殺劑。請回答下列問題:
)、氧硫化碳(COS)均可作儲糧害蟲殺劑。請回答下列問題:
(1)磷原子的核外電子排布式______________,核外有______種不同能量的電子;其最外層有____種運動狀態不同的電子,這些電子占據的軌道數為____個。
(2)氧硫化碳中,元素的非金屬性最強的元素在周期表中的位置是______;已知COS與![]() 的結構相似,試寫出COS的電子式______________,COS屬于_____分子(填“極性”或“非極性”)。
的結構相似,試寫出COS的電子式______________,COS屬于_____分子(填“極性”或“非極性”)。
氧硫化碳水解及部分應用流程如下(部分產物已略去):
COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
(3)寫出反應Ⅱ的離子方程式:_____________________;
(4)硫酸工業生產中接觸室內發生的反應方程式為___________;在實際生產中,操作溫度選定400~500℃、壓強通常采用常壓的原因分別是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com