
【題目】X、Y、Z三種短周期元素在周期表中的相對位置如下圖所示,Y原子的最外層電子數是次外層電子數的3倍,下列說法正確的是( )

A. Z元素的氧化物對應的水化物一定是一種強酸
B. 在三種元素形成的氣態氫化物中,Y的氣態氫化物最穩定
C. 三種元素原子半徑的大小順序為:X>Y>Z
D. Z的單質與 Fe 反應生成的化合物中,鐵元素顯+3價
【答案】B
【解析】
X、Y、Z三種短周期元素,根據元素周期表知,這三種元素是第二、三周期元素,Y位于第二周期,若Y原子的外層電子數是次外層電子數的3倍,則Y最外層有6個電子,則Y是O元素,X是N元素,Z是S元素,據此解答本題。
X、Y、Z三種短周期元素,根據元素周期表知,這三種元素是第二、三周期元素,Y位于第二周期,若Y原子的外層電子數是次外層電子數的3倍,則Y最外層有6個電子,則Y是O元素,X是N元素,Z是S元素;
A. Z是S元素,S元素的氧化物有SO2和SO3,其中SO2對應的水化物H2SO3是弱酸,故A錯誤;
B. 同一周期中,元素的非金屬性隨著原子序數的增大而增強,元素的非金屬性越強,其氫化物越穩定,Y的非金屬性大于X,所以氫化物的穩定性X<Y,同主族從上到下非金屬性依次減弱,Y的非金屬性大于Z,所以氫化物的穩定性Z<Y,故B正確;
C. 原子的電子層數越多其原子半徑越大,同一周期中,元素的原子半徑隨著原子序數的增大而減小,則原子半徑大小順序是Z>X>Y,故C錯誤;
D. S與Fe反應生成的是FeS,FeS中鐵元素顯+2價,故D錯誤。
故選B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】物質A~E均含同種元素,都是中學化學中常見的物質,C為藍色不溶于水的固體,它們可發生如下圖所表示的反應(除A~E外的其他物質已略去):

(1)寫出相應物質的類別:
物質 | B | C | D |
類別 | ___________ | ______________ | ______________ |
(2)在以上反應中(用序號填空):
屬于氧化還原反應的是________;屬于復分解反應的是________。
(3)寫出反應③和⑦的離子方程式:_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于各圖的敘述中正確的是
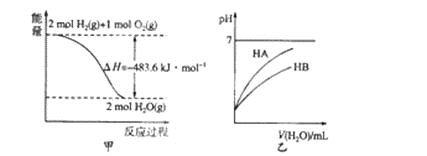
A. 圖甲表示l mol H2(g)完全燃燒生成水蒸氣吸收241.8 kJ熱量
B. 圖甲表示2 mol H2(g)所具有的能量比2 mol H2O(g)所具有的能量多483.6 kJ
C. 圖乙表示常溫下稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則同溫、同濃度的NaA溶液的pH小于NaB溶液的pH
D. 圖乙中起始時HA的物質的量濃度大于HB
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是

A. 圖Ⅰ表示鹽酸滴加到0.1 mol/L某堿溶液得到的滴定曲線,用已知濃度鹽酸滴定未知濃度該堿時最好選取酚酞作指示劑
B. 圖Ⅱ表示一定條件下進行的反應2SO2+O2![]() 2SO3 各成分的物質的量變化,t2時刻改變的條件可能是縮小容器體積
2SO3 各成分的物質的量變化,t2時刻改變的條件可能是縮小容器體積
C. 圖Ⅲ表示某明礬溶液中加入Ba(OH)2溶液,沉淀的質量與加入Ba(OH)2溶液體積的關系,在加入20 mL Ba(OH)2 溶液時鋁離子恰好沉淀完全
D. 圖Ⅳ表示pH相同的鹽酸與醋酸中分別加入水后溶液pH的變化,其中曲線a對應的是鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 2.8 g環已烷含共價鍵數目為0.4NA
B. 過氧化鈉與水反應,生成0.1 mol氧氣時,轉移的電子數為0.4NA
C. 142 g Na2SO4和Na2HPO4固體混合物中,陰陽離子總數為3NA
D. 用惰性電極電解CuSO4溶液后,如果加入0.1 molCu(OH)2能使溶液復原,則電路中轉移電子數為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常用鐵碳混合物處理含CuSO4廢水獲得金屬銅。當休持鐵屑和活性炭總質量不變時,測得廢水中Cu2+濃度在不同鐵碳質量比(x)條件下隨時問變化的曲線如圖所示。下列推論不合理的是

A. 由圖可知,活性炭對Cu2+具有一定的吸附作用
B. 鐵屑和活性炭會在溶液中形成微電池,鐵屑為負極
C. 利用鐵碳混合物回收含CuSO4廢水中銅的反應原理:Fe+CuSO4=FeSO4+Cu
D. 增大鐵碳混合物中鐵碳質量比(x),一定會提高廢水中Cu2+的去除速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人體血紅蛋白中含有Fe2+離子,如果誤食亞硝酸鹽,會使人中毒,因為亞硝酸鹽會使Fe2+離子轉變為Fe3+離子,生成高鐵血紅蛋白而喪失與O2結合的能力。服用維生素C可緩解亞硝酸鹽的中毒,這說明維生素C具有( )
A. 酸性B. 堿性C. 還原性D. 氧化性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅在工業中有重要作用,也是人體必需的微量元素。回答下列問題:
(1)Zn原子核外電子排布式為______________。
(2)黃銅是人類最早使用的合金之一,主要由Zn和Cu組成。第一電離能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________。
(3)ZnF2具有較高的熔點(872 ℃),其化學鍵類型是________;ZnF2不溶于有機溶劑而ZnCl2、ZnBr2、ZnI2能夠溶于乙醇、乙醚等有機溶劑,原因是______________。
(4)《中華本草》等中醫典籍中,記載了爐甘石(ZnCO3)入藥,可用于治療皮膚炎癥或表面創傷。ZnCO3中,陰離子空間構型為____,C原子的雜化形式為______。
(5)金屬Zn晶體中的原子堆積方式如圖所示,這種堆積方式稱為_______。
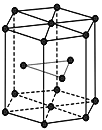
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com