
【題目】環戊烯是生產精細化工產品的重要中間體,其制備涉及的反應如下:
氫化反應: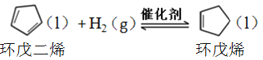 ,
,![]()
副反應: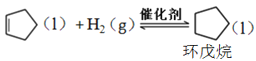 ,
,![]()
解聚反應: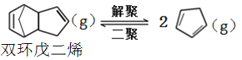 ,
,![]()
回答下列問題:
(1)反應![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定條件下,將環戊二烯溶于有機溶劑進行氫化反應(不考慮二聚反應),反應過程中保持氫氣壓力不變,測得環戊烯和環戊烷的產率(以環戊二烯為原料計)隨時間變化如圖所示:
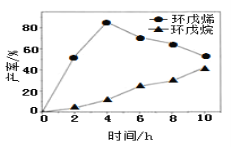
①0~4h氫化反應速率比副反應快的可能原因是_________。
②最佳的反應時間為__h。若需迅速減慢甚至停止反應,可采取的措施有____(寫一條即可)。
③一段時間后,環戊烯產率快速下降的原因可能是_________。
(3)解聚反應在剛性容器中進行(不考慮氫化反應和副反應)。
①其他條件不變,有利于提高雙環戊二烯平衡轉化率的是 ____(填標號)。
A.增大雙環戊二烯的用量 B.使用催化劑 C.及時分離產物 D.適當提高溫度
②實際生產中常通入水蒸氣以降低雙環戊二烯的溫度(水蒸氣不參與反應)。某溫度下,通入總壓為300 kPa的雙環戊二烯和水蒸氣,達到平衡后總壓為500 kPa,雙環戊二烯的轉化率為80%,則p(H2O)=______kPa,平衡常數Kp=_______kPa (Kp為以分壓表示的平衡常數)。
【答案】-209.9 氫化反應的活化能小或反應物的濃度大 4 排出氫氣或急劇降溫 副反應增加 CD 50 3200
【解析】
(1)結合蓋斯定律計算,氫化反應+副反應得到反應的△H;
(2)①根據活化能或濃度對反應速率的影響分析;
②根據圖象可知,在4h時環戊烯產率最大、環戊烷產率較小;根據外界條件對化學反應速率的影響分析迅速減慢甚至停止反應的措施。
③副反應增加導致環戊烯的產率降低;
(3)①根據影響化學平衡移動的因素及物質的轉化率的變化分析;
②用三段式法先計算物質的平衡物質的量,根據物質在同溫同體積時壓強比等于氣體的物質的量之比計算平衡常數及物質產生的壓強大小。
(1)結合蓋斯定律計算,氫化反應+副反應得到反應![]() △H=-209.9kJ/mol;
△H=-209.9kJ/mol;
(2)①0~4h氫化反應速率比副反應快的可能原因是氫化反應的活化能小或反應物的濃度大;
②根據圖象可知,在4h時環戊烯產率最大、環戊烷產率較小,說明最佳的反應時間為4h;若需迅速減慢甚至停止反應,可采取的措施有:排出氫氣,或利用溫度對化學反應速率的影響,將反應體系的溫度降低,即急劇降溫也可以降低反應速率;
③一段時間后,環戊烯產率快速下降的原因可能是副反應增加,導致環戊烯的產率降低;
(3) A.增大雙環戊二烯的用量,平衡正向移動,但是加入的雙環戊二烯使平衡正向移動消耗量遠小于增大雙環戊二烯的用量使其濃度增大的量,因此增大雙環戊二烯的用量,雙環戊二烯的轉化率降低,A錯誤;
B.使用催化劑化學平衡不發生移動,雙環戊二烯的平衡轉化率不變,B錯誤;
C.及時分離產物,由于生成物濃度降低,平衡正向移動,使更多的雙環戊二烯發生反應,因此雙環戊二烯的轉化率增大,C正確;
D.由于該反應的正反應是吸熱反應,適當提高溫度,化學平衡正向移動,使更多的雙環戊二烯發生反應,因此雙環戊二烯的轉化率增大,D正確;
故答案是CD;
②假設反應前雙環戊二烯的物質的量為a,水蒸氣的物質的量為b,
化學反應: 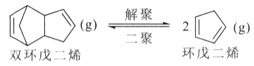
n(開始)(mol) a 0
n(轉化)(mol) 0.8a 1.6a
n(平衡)(mol) 0.2a 1.6a
在同溫同體積時,氣體的壓強與氣體的物質的量呈正比,反應前總壓為300 kPa,反應達到平衡后總壓為500 kPa,![]() ,解得
,解得![]() ,由于反應前氣體的總壓強為300kPa,所以p(H2O)=
,由于反應前氣體的總壓強為300kPa,所以p(H2O)=![]() ×300kPa=50kPa,
×300kPa=50kPa,![]() ,由于
,由于![]() ,所以p(雙環戊二烯) 平衡=50kPa,p(環戊二烯)平衡=
,所以p(雙環戊二烯) 平衡=50kPa,p(環戊二烯)平衡=![]() p(雙環戊二烯)平衡=8×50kPa=400kPa,所以平衡常數Kp=
p(雙環戊二烯)平衡=8×50kPa=400kPa,所以平衡常數Kp=![]() =3200kPa。
=3200kPa。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】反應4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的熱量。
2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的熱量。
又知:![]()

![]() ,
,![]()

 ;
;
判斷下列說法正確的是( )
A. 該反應的ΔH=+115.6 kJ·mol-1
B. 斷開1 mol H—O 鍵與斷開1 mol H—Cl 鍵所需能量相差約為32 kJ
C. HCl中H—Cl 鍵比H2O中H—O鍵穩定
D. 由題中所提供信息判斷氯元素的非金屬性比氧元素強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在新制飽和氯水中,若只改變某一條件,下列敘述正確的是
A. 再通入少量氯氣,![]() 減小
減小
B. 通入少量SO2,溶液漂白性增強
C. 加入少量的碳酸鈉粉末,pH增大,溶液漂白性減弱
D. 光照過程中,有氣泡冒出,溶液的導電性增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A由Al2O3、Fe3O4、Al、Cu中的某幾種粉末混合而成,設計成分分析方案如下,下列分析不正確的是( )
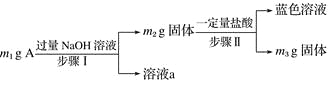
A. 當m1>m2時,溶液a中陰離子只有1種
B. 生成藍色溶液的離子方程式涉Cu+2Fe3+===Cu2++2Fe2+
C. 要確定混合物中是否含Al,可取A加入適量稀HCl
D. 當m2-m3=2.96 g,Fe3O4的質量至少為2.32 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以乙醇為原料,用下述6種類型的反應:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,來合成乙二酸乙二酯(![]() )的正確順序是( )
)的正確順序是( )
A. ①⑤②③④B. ①②③④⑤
C. ②③⑤①⑥D. ②③⑤①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 某有機物燃燒只生成CO2和H2O,且二者物質的量相等,則此有機物的組成為CnH2n
B. 一種烴在足量的氧氣中燃燒并通過濃硫酸,減少的總體積就是生成的水蒸氣的體積
C. 某氣態烴CxHy與足量O2恰好完全反應,如果反應前后氣體體積不變(溫度>100℃),則y=4;若體積減小,則y>4;否則y<4
D. 相同質量的烴,完全燃燒,消耗O2越多,烴中含H量越高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示小麥開花數天后測定種子中主要物質的變化,請據圖回答下列問題:

(1)成熟小麥種子中主要的營養物質是________。
(2)檢測還原糖的試劑是________,還原糖的多少可通過________來判斷。
(3)小麥種子成熟過程中,胚乳里蔗糖與還原糖含量比較,兩者的變化趨勢________________(填“相同”或“不同”)。
(4)種子成熟時,淀粉的形成與一種磷酸化酶的活性有密切關系,為驗證磷酸化酶是否是蛋白質,實驗過程中實驗組試管加入________,對照組試管中加入2 mL豆漿,然后加入等量的________,如果均出現________現象,則證明磷酸化酶是蛋白質。
(5)播種等量的小麥種子和花生種子,________種子需要淺播,因為該種子中_______化合物含量多,該化合物元素組成特點是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,m g氣體A與n g氣體B的分子數相同,下列說法中不正確的是
A. 兩種氣體A與B的相對分子質量之比為m∶n
B. 同質量氣體A與B的分子數之比為n∶m
C. 同溫同壓下,A、B兩氣體的密度之比為n∶m
D. 相同狀況下,同體積A、B兩氣體的質量之比為m∶n
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】食鹽是日常生活的必需品,也是重要的化工原料。粗食鹽常含有少量Ca2+、Mg2+、Fe3+、SO42-等雜質離子,實驗室提純NaC1的流程如下:
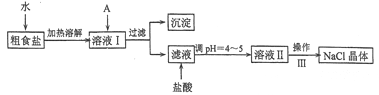
(1)加入A試劑,是為了除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-離子。A代表的是多種試劑,按滴加順序依次為:iNaOH,ⅱ__________,ⅲ_________(填化學式)。
(2)請寫出下列試劑加入試劑i時發生主要反應的離子反應方程式:_________
(3)右下圖是某學生的過濾操作示意圖,其操作不規范的是________(填標號)。
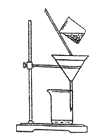
a.漏斗末端頸尖未緊靠燒杯壁
b.玻璃棒用作引流
c.將濾紙濕潤,使其緊貼漏斗壁
d.濾紙邊緣高出漏斗
e.用玻璃棒在漏斗中輕輕攪動以加快過濾速度
(4)操作III的名稱是__________
(5)mg粗鹽提純后得到ng純凈的NaCl固體,則m與n的大小關系為_________.
A.m>n B. m=n C. m<n D. 無法確定.
(6)實驗室需配制480 mL0.400mol/L鹽酸,現用如圖所示濃鹽酸配制,回答下列問題:
鹽酸
分子式: HCl
相對分子質量: 36.5
密度: 1.2g/cm3
HCl的質量分數為: 36.5%
①配制需要的玻璃儀器有玻璃棒、量簡、燒杯、________(填儀器名稱)
②需量取濃鹽酸的體積為:__________mL。(結果保留1位小數)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com