
【題目】根據下列變化進行推斷:
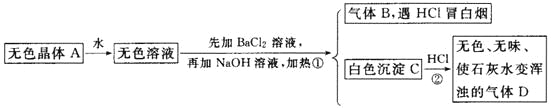
且已知對A加強熱產生的氣態物質的平均相對分子質量為26.3。
(1)推斷A、B、C、D的化學式:A________,B________,C________,D________。
(2)寫出①②變化的離子方程式:
①________________________________________________________________;
②________________________________________________________________。
【答案】NH4 HCO3 NH3 BaCO3 CO2 ![]() +
+![]() +Ba2 + +2OH-
+Ba2 + +2OH- ![]() NH3 ↑+BaCO3 ↓+2H2O BaCO3 +2H+ ══Ba2 + +CO2 ↑+H2 O
NH3 ↑+BaCO3 ↓+2H2O BaCO3 +2H+ ══Ba2 + +CO2 ↑+H2 O
【解析】
氣體B遇HCl冒白煙,則氣體B為NH3,加氯化鋇溶液后產生的白色沉淀C遇鹽酸產生無色無味的氣體能使石灰水變渾,則C為BaCO3 ,D為CO2,據此可推斷無色溶液中應含有碳酸根離子和銨根離子,則A可能為NH4 HCO3或(NH4 )2CO3,如果是NH4 HCO3,則分解產生的氣體的平均相對分子質量為![]() =26.3,如果是(NH4 )2CO3,則分解產生的氣體的平均相對分子質量為
=26.3,如果是(NH4 )2CO3,則分解產生的氣體的平均相對分子質量為![]() =24,根據對A加強熱產生的氣態物質的平均相對分子質量為26.3可知,A為NH4 HCO3,據此答題。
=24,根據對A加強熱產生的氣態物質的平均相對分子質量為26.3可知,A為NH4 HCO3,據此答題。
氣體B遇HCl冒白煙,則氣體B為NH3,加氯化鋇溶液后產生的白色沉淀C遇鹽酸產生無色無味的氣體能使石灰水變渾,則C為BaCO3 ,D為CO2,據此可推斷無色溶液中應含有碳酸根離子和銨根離子,則A可能為NH4 HCO3或(NH4 )2CO3,如果是NH4 HCO3,則分解產生的氣體的平均相對分子質量為![]() =26.3,如果是(NH4 )2CO3,則分解產生的氣體的平均相對分子質量為
=26.3,如果是(NH4 )2CO3,則分解產生的氣體的平均相對分子質量為![]() =24,根據對A加強熱產生的氣態物質的平均相對分子質量為26.3可知,A為NH4 HCO3,據此答題。
=24,根據對A加強熱產生的氣態物質的平均相對分子質量為26.3可知,A為NH4 HCO3,據此答題。
(1)根據上面的分析可知,A為NH4 HCO3,B為NH3,C為BaCO3 ,D為CO2;
故答案為:NH4 HCO3;NH3;BaCO3 ;CO2;
(2)反應①的離子方程式為NH4++HCO3-+Ba2++2OH-═NH3↑+BaCO3↓+2H2O,反應②的離子方程式為BaCO3 +2H+═Ba2++CO2↑+H2 O;
故答案為:NH4++HCO3-+Ba2++2OH-═NH3↑+BaCO3↓+2H2O;BaCO3 +2H+═Ba2++CO2↑+H2 O。


科目:高中化學 來源: 題型:
【題目】同主族元素所形成的同一類型的化合物,往往其結構和性質相似。化合物![]() 是一種晶體,下列對它的敘述中,錯誤的是
是一種晶體,下列對它的敘述中,錯誤的是
A.它是一種離子化合物
B.這種化合物水溶液顯中性
C.這種化合物加熱能分解
D.這種化合物能與氫氧化鈉溶液發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電催化合成氨法在電能的推動下不受熱力學平衡限制,實現N2、H2O常溫常壓合成氨,如圖為N2在不同電極材料表面復化的機制示意圖。下列說法正確的是( )
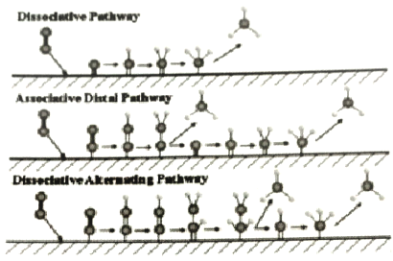
A.電極材料起吸附作用,不影響N2的氫化過程
B.N2在氫化反應之前需先解離成單獨的氮原子
C.電催化合成氨原子利用率100%
D.2.8gN2理論上可以產生0.2NA個NH3分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水是巨大的化學資源寶庫,利用海水可以提取很多物質。
利用1:提溴工業
用海水曬鹽之后的鹽鹵可提取溴,提取流程如圖:
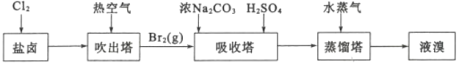
(1)吹出塔中熱空氣能將溴單質吹出的原因是_____。蒸餾塔中通入水蒸氣進行加熱,需要控制溫度在90℃左右的原因是______。
利用2:提鎂工業
從海水提取食鹽和Br2之后的鹽鹵中除含有Mg2+、C1-外,還含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等,還可以用來提取MgCl2、MgO、Mg(OH)2等物質,流程如圖所示:
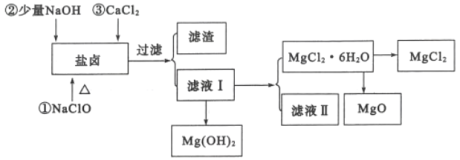
(2)用NaC1O除去尿素CO(NH2)2時,生成物除鹽外,還有能參與大氣循環的無毒物質,則該反應的化學方程式為_______;加入NaC1O的另一個作用是________。
利用3:淡化工業
(3)海水淡化的方法主要有閃蒸法、離子交換法、電滲析法等。離子交換法淡化海水模擬過程如圖所示。氫型陽離子交換原理可表示為:HR+Na+=NaR+H+;……。羥型陰離子交換樹脂填充部分存在的反應有:ROH+C1-=RC1+OH-;______;________。
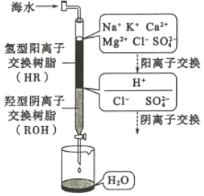
(4)電滲析法是一種利用離子交換膜進行海水淡化的方法,其原理如圖所示:
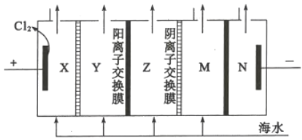
①圖中的海水沒有直接通入到陰極室中,其原因是_________。
②淡化水在________室(填X、Y、Z、M或N)形成后流出。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作中選用的部分儀器,不合理的是( )
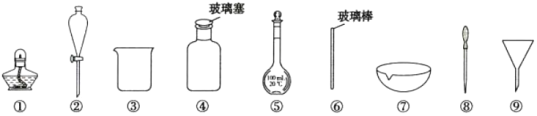
A.配制100 mL0.1 mol·L-1NaC1溶液,選用③、⑤、⑥和⑧
B.盛放NaOH溶液,選用④
C.分離I2的四氯化碳溶液和水,選用②、③
D.從食鹽水中獲得食鹽,選用①、⑥、⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下向10 mL pH=3的醋酸溶液中加水稀釋后,下列說法正確的是( )
A.氫離子的數目減少
B.溶液中![]() 不變
不變
C.醋酸的電離程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用發煙HC1O4將潮濕的CrC13氧化為棕色的煙[CrO2(C1O4)2],來除去Cr(Ⅲ),HC1O4中部分氯元素轉化為最低價態。下列說法錯誤的是( )
A.CrO2(C1O4)2中Cr元素顯+6價
B.HC1O4屬于強酸,該反應還生成了另一種強酸
C.該反應中,參加反應的氧化劑與氧化產物的物質的量之比為3:8
D.該反應離子方程式為19ClO![]() +8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O
+8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】計算下列各題在常溫下的數值(lg2=0.3、lg3=0.477、lg5=0.7)。
(1)0.005mol/L的氫氧化鋇溶液的PH=____。
(2)0.1mol/L的醋酸的PH=_____(電離度=1%)。
(3)pH=12的NaOH溶液加水稀釋到原來的10倍,則溶液的pH=_____。
(4)pH=12氨水加水稀釋到原來100倍,溶液的pH值范圍___________。
(5)PH=1和PH=3的硫酸等體積混合后溶液的PH=______,c(H+)水=_____。
(6)pH=13 的強堿與 pH=2 的強酸溶液混合,所得混合液的 pH=11,則強堿與強酸的體積比為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA是阿伏加德羅常數的值。下列說法正確的是( )
A.1molNaHSO4固體中含有離子總數為3NA
B.11.2L(標準狀況)HF含有質子數為5NA
C.50g46%的乙醇水溶液中,含有O—H鍵數為3.5NA
D.1molCu與足量的硫蒸氣反應,轉移電子數為2NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com