
【題目】以下反應均可生成![]() 。下列有關說法正確的是
。下列有關說法正確的是![]()
![]() 二氧化碳分解生成氧氣:
二氧化碳分解生成氧氣:![]() ;
;![]()
![]() 過氧化氫分解生成氧氣:
過氧化氫分解生成氧氣:![]() ;
;![]()
![]() 光照條件下,催化分解水蒸氣生成氧氣:
光照條件下,催化分解水蒸氣生成氧氣:![]() ;
;![]() 。
。
A.反應![]() 使用催化劑,能降低該反應的活化能
使用催化劑,能降低該反應的活化能
B.反應![]() 為吸熱反應
為吸熱反應
C.反應![]() 將化學能轉化為光能
將化學能轉化為光能
D.反應![]() ;
;![]()
 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:
【題目】一定溫度時,向容積為 2 L 的密閉容器中充入一定量的 SO2(g)和 O2(g),發生反應:2SO2(g)+ O2(g)2SO3(g) △H = - 196 kJ/mol。一段時間后反應達到平衡狀態,反應過程中測定的部分數據如表所示。
反應時間/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列說法不正確的是
A.前 5 min 的平均反應速率為v(SO2) = 0.08 mol/(L·min)
B.保持溫度不變,向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)時, v正 > v逆
C.保持其他條件不變,若起始時向容器中充入 2 mol SO3(g),達到平衡狀態時吸收 78.4 kJ的熱量
D.相同條件下,起始時向容器中充入 1.5 mol SO3(g),達到平衡狀態時 SO3 的轉化率為 40%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種元素,其原子序數依次增大,且質子數均小于18。A元素原子的最外層只有1個電子,該元素陽離子與N3-核外電子排布相同;B元素原子核外各軌道上均無成單電子;C元素原子的價電子排布為ns2np2;D-的核外電子構型與Ar相同。
(1)寫出A、C、D的元素符號:A________,C________,D________。
(2)寫出B元素電子的電子排布式________;D元素電子的電子排布圖______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著科技進步和人類環保意識的增強,如何利用CO2已經成為世界各國特別關注的問題。
已知:CO2與CH4經催化重整制得合成氣:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低溫度,該反應速率會_______________(填“增大”或“減小”);一定壓強下,由最穩定單質生1 mol化合物的焓變為該物質的摩爾生成焓。已知CO2(g)、CH4(g)、CO(g)的摩爾生成焓分別為-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。則上述重整反應的ΔH=____________kJ/mol。
(2)T1℃時,在兩個相同剛性密閉容器中充入CH4和CO2分壓均為20 kPa,加入催化劑Ni/α-Al2O3并分別在T1℃和T2℃進行反應,測得CH4轉化率隨時間變化如圖Ⅰ所示。
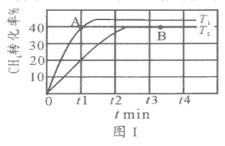
①A點處v正_______B點處(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A點處v生成(CO)=__________mol·g-1·s-1。
(3)上述反應達到平衡后,若改變某一條件,下列變化能說明平衡一定正向移動的是________________(填代號)。
A.正反應速率增大 B.生成物的百分含量增大 C.平衡常數K增大
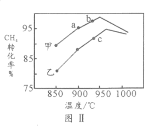
(4)其他條件相同,在甲、乙兩種不同催化劑作用下,相同時間內測得CH4轉化率與溫度變化關系如圖Ⅱ,C點___________________(填“可能”、“一定”或“一定未”)達到平衡狀態,理由是_____________;CH4的轉化率b點高于a點的可能原因是_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常溫下,取體積比為4:1的甲烷和H2的混合氣體112L(標準狀況下),經完全燃燒后恢復到常溫,則放出的熱量為
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵、銅及其化合物在工農業生產中應用廣泛。
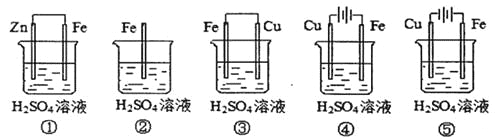
(1)在潮濕空氣中,鋼鐵發生電化學腐蝕轉化為Fe(OH)2的反應方程式為_______。在含有等濃度硫酸溶液的下列裝置中,鐵腐蝕的速率由快到慢的順序是____________(用序號填寫)。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)![]() H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)![]() H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
則焊接鋼軌時鋁與Fe3O4發生反應生成鐵和Al2O3的熱化學方程式為______________。
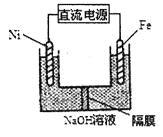
(3)Na2FeO4具有強氧化性,其電解制法如圖所示,請寫出陽極的電極反應式______。Na2FeO4是一種既能殺菌、消毒,又能絮凝凈水的水處理劑,其原理是______________。
(4)工業上常用FeCl3溶液腐蝕印刷線路板,發生反應的離子方程式是____________。若腐蝕銅板后的溶液中,Cu2+、Fe3+和Fe2+濃度均為0.1 mol·L-1,結合下圖分析,當混合溶液中通入氨氣調節溶液的pH=5.6時,溶液中存在的金屬陽離子為____。從圖中數據計算Fe(OH)2的溶度積Ksp[Fe(OH)2]=______。
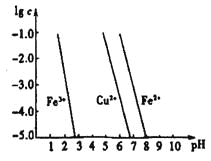
已知:橫坐標為溶液的pH,縱坐標為金屬離子的物質的量濃度的對數(當溶液中金屬離子濃度![]() 10-5mol·L-1時,可認為沉淀完全)。
10-5mol·L-1時,可認為沉淀完全)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車內燃機燃燒時,在高溫引發氮氣和氧氣反應會產生 NOx 氣體,NOx 的消除是科研人員研究的重要課題。
(1)通過資料查得 N2(g)+O2(g)2NO(g)△H反應溫度不平衡常數的關系如下表:
反應溫度/℃ | 1538 | 2404 |
平衡常數 |
|
|
則△H___________________0(填“<”“>”戒“=”)
(2)在 800℃時,測得 2NO(g)+O2(g) 2NO2(g)的反應速率不反應物濃度的關系如下表所示
初始濃度/ | 初始速率/ | |
C0(NO) | C0(O2) | |
0.01 | 0.01 |
|
0.01 | 0.02 |
|
0.03 | 0.02 |
|
已知反應速率公式為 V 正=K 正×c m(NO)cn(O2),則 m=___________________, K 正=___________________L2mol-2s-1
(3)在某溫度下(恒溫),向體積可變的容器中充人 NO2 氣體,發生反應 2NO2(g) N2O4(g),氣體分壓隨時間的變化關系如圖
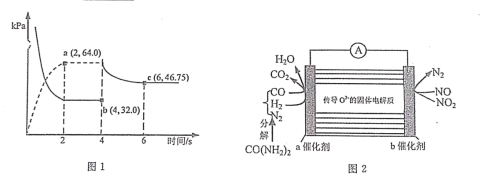
①該反應的壓力平衡常數 KP=___________________。
②4s 時壓縮活塞(活塞質量忽略不計)使容器體積變為原體積的 1/2,6s 時重新達到平衡,則P(N2O4)=___________________kPa。
(4)某學習小組利用圖 2 裝置探究向汽車尾氣中噴入尿素溶液處理氮的氧化物。則該裝置工作時,NO2 在 b 電極上的電極反應式為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中互為同分異構體的有____,互為同素異形體的 有________,互為同位素的有________,是同一種物質的有________(填序號)。
(1)液氯 (2)氯氣(3)白磷(4)紅磷 (5)35Cl (6)37Cl
(7)![]() (8)
(8)![]() (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向質量為6.5g的Al和Fe的混合物中加入一定量稀HNO3恰使混合物完全溶解,放出NO(標準狀況)2.24L,所得溶液中再滴加KSCN溶液,無紅色出現。若用相同質量的上述混合物與足量的稀硫酸充分反應,所得到的氣體在標準狀況下的體積為( )
A.15.12LB.10.08LC.2.24LD.3.36L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com