
能促進水的電離,并使溶液中c(H+)>c(OH-)的操作是 ( )
①將水加熱煮沸 ②向水中投入一小塊金屬鈉 ③向水中通CO2 ④向水中加入NH4Cl固體 ⑤向水中加入NaHCO3固體 ⑥向水中加入NaHSO4固體
| A.①②⑤ | B.①④ | C.③④⑥ | D.④ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:單選題
高氯酸、硫酸、硝酸和鹽酸都是強酸,其酸性在水溶液中差別不大。以下是某溫度下這四種酸在冰醋酸中的電離常數(shù):從下表格中判斷下列說法正確的是
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列化學實驗事實及其解釋或結論都正確的是( )
| A.取少量溶液X,向其中加入適量新制氯水,再加幾滴KSCN溶液,溶液變紅,說明X溶液中一定含有Fe2+ |
| B.用乙醇、冰醋酸及pH=0的H2SO4加熱可制乙酸乙酯,用飽和的Na2CO3溶液可以洗去其中含有的乙醇和乙酸,說明乙酸乙酯在Na2CO3溶液中的溶解度很小 |
| C.向濃度均為0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成藍色沉淀,說明Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
| D.配制0.10mol/L NaCl溶液,俯視容量瓶的刻度線定容,所配溶液濃度偏大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在0.1 mol·L-1的HCN溶液中存在如下電離平衡HCN H++CN-,對該平衡,下列敘述正確的是( )
H++CN-,對該平衡,下列敘述正確的是( )
| A.加入少量NaOH固體,平衡向正反應方向移動 |
| B.加水,平衡向逆反應方向移動 |
| C.滴加少量0.1 mol·L-1 HCl溶液,溶液中c(H+)減少 |
| D.加入少量NaCN固體,平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法不正確的是 ( )
| A.Ksp只與難溶電解質的性質和溫度有關 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定條件下可轉化為CuS沉淀 |
| C.其他條件不變,離子濃度改變時,Ksp不變 |
| D.兩種難溶電解質作比較時,Ksp小的,溶解度一定小 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
水的電離平衡曲線如圖所示,下列說法不正確的是 ( )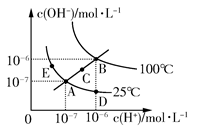
| A.圖中五點KW間的關系:B>C>A=D=E |
| B.若從A點到D點,可采用在水中加入少量酸的方法 |
| C.若從A點到C點,可采用溫度不變時在水中加入適量NH4Cl固體的方法 |
| D.若處在B點時,將pH=2的硫酸與pH=10的KOH等體積混合后,溶液顯中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
常溫下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A.將溶液稀釋到原體積的 10倍 |
| B.加入適量的醋酸鈉固體 |
| C.加入等體積0.2 mol·L-1鹽酸 |
| D.提高溶液的溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
有關水的電離平衡的說法正確的是( )
| A.水的離子積通常用KW來表示,隨溫度變化而變化,只適用于純水,在稀鹽酸中數(shù)值會變大 |
| B.在純水中加入硫酸會抑制水的電離,加醋酸會促進水的電離 |
| C.鹽溶于水對水的電離平衡均沒有影響 |
| D.在純水中加入氫氧化鐵固體對水的電離平衡會有微弱的影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列溶液一定呈中性的是 ( )。
| A.c(H+)=c(OH-)=10-6 mol·L-1的溶液 |
| B.pH=7的溶液 |
| C.使石蕊試液呈紫色的溶液 |
| D.酸與堿恰好完全反應生成正鹽的溶液 |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com