
【題目】將9.0 g銅和鐵的混合物投入100 mL稀硝酸中并加熱,充分反應后得到標準狀況下1.12 L NO,剩余4.8 g金屬;繼續加入100 mL等濃度的稀硝酸,金屬完全溶解,又得到標準狀況下1.12 L NO。若向反應后的溶液中加入KSCN溶液,溶液不變紅,則下列說法正確的是 ( )
A.原混合物中銅和鐵的物質的量均為0.075 mol
B.反應前稀硝酸的物質的量濃度無法計算
C.若向上述最后所得溶液中再加入足量稀硝酸,還可得到標準狀況下1.12 L NO
D.第一次與100 mL稀硝酸反應后剩余的4.8 g金屬為銅和鐵
【答案】A
【解析】
第一次加硝酸時金屬有剩余,無論參加反應的是鐵還是鐵和銅,溶解的4.2克金屬均被氧化到+2價:3Fe(或3Cu)+8HNO3=3Fe(NO3)2[或3Cu(NO3)2]+2NO↑+4H2O,金屬的物質的量為![]() ×
×![]() =0.075mol ,則第一次溶解的金屬摩爾質量為56g·mol-1,所以第一次溶解的是鐵。第二次加硝酸后的溶液不能使KSCN溶液變紅,溶解的4.8克金屬也一定被氧化到+2價,同理可得其物質的量為0.075mol,金屬摩爾質量為64g·mol-1,是銅。
=0.075mol ,則第一次溶解的金屬摩爾質量為56g·mol-1,所以第一次溶解的是鐵。第二次加硝酸后的溶液不能使KSCN溶液變紅,溶解的4.8克金屬也一定被氧化到+2價,同理可得其物質的量為0.075mol,金屬摩爾質量為64g·mol-1,是銅。
A. 根據分析,第一次溶解的是0.075mol鐵,第二次溶解的是0.075mol銅,原混合物中銅和鐵的物質的量均為0.075 mol,故A正確;
B. 根據氮元素守恒,反應前稀硝酸的物質的量濃度為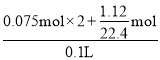 =2mol/L,故B錯誤;
=2mol/L,故B錯誤;
C. 若向上述最后所得溶液中再加入足量稀硝酸,亞鐵離子被氧化為鐵離子,反應為3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,生成NO的物質的量是![]() ,標準狀況下的體積為0.56 L NO,故C錯誤;
,標準狀況下的體積為0.56 L NO,故C錯誤;
D. 根據以上分析,第一次與100 mL稀硝酸反應后剩余的4.8 g金屬為銅,不含鐵,故D錯誤;
選A。


科目:高中化學 來源: 題型:
【題目】下列依據熱化學方程式得出的結論正確的是( )
A.已知C(s,金剛石)=C(s,石墨) △H<0,則金剛石比石墨穩定
B.已知2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1,則CO的燃燒熱為566.0kJ·mol-1
C.已知C(s,石墨)+O2(g)=CO2(g) △H=akJ·mol-1,C(s,石墨)+![]() O2(g)=CO(g) △H=bkJ·mol-1,則a>b
O2(g)=CO(g) △H=bkJ·mol-1,則a>b
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,則含lmolNaOH的稀溶液與稀醋酸完全中和,放出的熱量小于57.3kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物R的結構簡式如圖,下面有關說法不正確的是( )

A.1molR與足量的Na反應能生成1molH2
B.1molR最多能消耗2molNaOH
C.R能發生取代反應、加成反應、氧化反應、還原反應等反應類型
D.1molR完全燃燒消耗16molO2
查看答案和解析>>
科目:高中化學 來源: 題型:
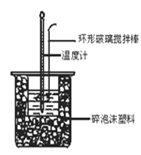
【題目】下列有關中和熱概念、中和熱測定實驗(如圖)的說法正確的是
A.已知在稀溶液中:H+(aq)+OH-(aq) =H2O(l);ΔH=-57.3kJ·mol-1,則有![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)= ![]() BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
B.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.6kJ·mol-1,則該反應的中和熱為114.6 kJ·mol-1。
C.中和熱測定實驗過程中,環形玻璃攪拌棒材料若用銅代替,則測量出的中和熱數值偏小
D.酸堿混合時,量筒中的NaOH溶液應分多次倒入已裝有鹽酸的小燒杯中,并不斷用環形玻璃攪拌棒攪拌。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個不傳熱的固定容積的密閉容器中,可逆反應N2(g)+3H2(g)![]() 2NH3(g),達到平衡的標志是
2NH3(g),達到平衡的標志是
①反應速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2;②各組分的物質的量濃度不再改變;③體系的壓強不變;④混合氣體的密度不變 (相同狀況);⑤體系的溫度不再發生變化;⑥2 v(N2)(正)=v(NH3)(逆) ;⑦單位時間內有3mol H—H斷裂同時有2mol N—H斷裂。
A.①②③⑤⑥⑦B.②③④⑤⑥C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校學生化學實驗小組,為驗證非金屬元素氯的氧化性強于硫和氮,設計了一套實驗裝置:(部分夾持裝置已略去)
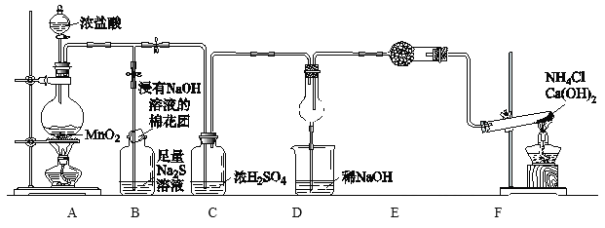
(1)寫出A中反應的離子方程式___________________________。
(2)寫出F中反應的化學方程式_________________________。
(3)B中浸有NaOH溶液的棉花作用___________________,B中溶液出現現象_______________,寫出B中發生的離子反應_________________。
(4)E中干燥管裝的干燥劑是________,檢驗F中氣體的方法______________。
(5)D中干燥管中出現的現象______________,D中干燥管中化學方程式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.已知2A2(g)+B2(g)![]() 2C(g) ΔH=-a kJ/mol(a>0),在一個有催化劑的固定容積的容器中加入2 mol A2和1 mol B2,在500 ℃時充分反應達到平衡后C的濃度為w mol/L,放出熱量b kJ。
2C(g) ΔH=-a kJ/mol(a>0),在一個有催化劑的固定容積的容器中加入2 mol A2和1 mol B2,在500 ℃時充分反應達到平衡后C的濃度為w mol/L,放出熱量b kJ。
(1)a________b(填“>”“=”或“<”)。
(2)若將反應溫度升高到700 ℃,該反應的平衡常數將________(填“增大”“減小”或“不變”)。
(3)若在原來的容器中,只加入2 mol C,500 ℃時充分反應達到平衡后, C的濃度________w mol/L(填“>”“=”或“<”)
(4)使該反應的反應速率增大,且平衡向正反應方向移動的操作是________。
a.及時分離出C氣體 b.適當升高溫度
c.增大B2的濃度 d.選擇高效的催化劑
II.氮化硅(Si3N4)是一種新型陶瓷材料,它可由石英與焦炭在高溫的氮氣流中,通過以下反應制得:3SiO2(s)+6C(s)+ 2N2(g)![]() Si3N4(s)+ 6CO(g) △H>0 。
Si3N4(s)+ 6CO(g) △H>0 。
(1)該反應的平衡常數表達式為__________。
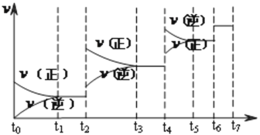
(2)達到平衡后,改變某一外界條件(不改變N2、CO的量),反應速率![]() 與時間t的關系如下圖。圖中t3時引起平衡移動的條件可以是____________________;t4時引起平衡移動的條件可以是____________________;圖中表示平衡混合物中CO的含量最高的一段時間是_________。
與時間t的關系如下圖。圖中t3時引起平衡移動的條件可以是____________________;t4時引起平衡移動的條件可以是____________________;圖中表示平衡混合物中CO的含量最高的一段時間是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列敘述不正確的是( )
A.60gSiO2晶體含4NA個σ鍵
B.78gNa2O2晶體中含有離子個數為4NA
C.在12g石墨中含CC共價鍵數目為1.5NA
D.CO和N2是等電子體,標況下22.4L的CO氣體與1molN2所含的電子數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鉬在工業和國防建設中有重要的作用。鉬(Mo)的常見化合價為+6、+5、+4。由鉬精礦(主要成分是MoS2)可制備單質鉬和鉬酸鈉晶體(Na2MoO4·2H2O),部分流程如圖1所示:
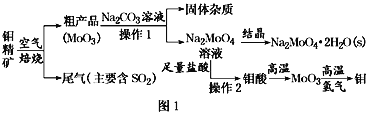
已知:鉬酸微溶于水,可溶于液堿和氨水。
回答下列問題:
(1)焙燒鉬精礦時發生的化學方程式為_____________________________。
(2)鉬精礦焙燒時排放的尾氣對環境的主要危害是___________________,請提出一種實驗室除去該尾氣的方法____________________________________。
(3)操作2的名稱為________。由鉬酸得到MoO3所用到的硅酸鹽材料儀器的名稱是________。
(4)焙燒鉬精礦所用的裝置是多層焙燒爐,圖2為各爐層固體物料的物質的量的百分數(φ)。
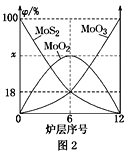
①x=________。
②焙燒爐中也會發生MoS2與MoO3反應生成MoO2和SO2的反應,若該反應轉移6mol電子,則消耗的氧化劑的化學式及物質的量分別為________、________。
(5)操作1中,加入碳酸鈉溶液充分反應后,堿浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在結晶前需加入Ba(OH)2固體以除去溶液中的SO42-。當BaMoO4開始沉淀時,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液體積變化可忽略不計]
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com