
【題目】氯氣貯運不方便,且具有一定的危險性,目前正逐漸被其他性能優越的消毒產品所替代.請回答:
(1)氯堿工業生產氯氣的化學方程式為 .
(2)84消毒液與氯氣相比具有貯運方便等優點,用氯氣與燒堿溶液反應制備84消毒液的離子方程式為 .
(3)二氧化氯是目前國際上公認的最新一代的高效、廣譜、安全的殺菌、保鮮劑.我國科學家研發了用氯氣氧化亞氯酸鈉(NaClO2)固體制備二氧化氯的方法,其化學方程式為 .
(4)一位同學設計了一套用濃鹽酸和KMnO4固體制取少量氯氣并比較氯氣與碘單質的氧化性強弱的微型裝置(如圖). 
①下列溶液能吸收Cl2的是(填字母序號).
A.飽和食鹽水 B.飽和Na2SO3溶液C.飽和NaOH溶液 D.濃硫酸
②能說明Cl2的氧化性強于I2的實驗現象是 , 從原子結構角度解釋Cl2的氧化性強于I2的原因: .
【答案】
(1)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(2)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(3)Cl2+2NaClO2=2ClO2+2NaCl
(4)BC;濕潤淀粉碘化鉀試紙變藍;同主族元素從上到下,原子半徑依次變大,得電子能力依次減弱,氧化能力依次減弱
【解析】解:(1)氯堿工業生產氯氣,電解飽和食鹽水,反應為2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;(2)用氯氣與燒堿溶液反應制備84消毒液,生成NaCl、NaClO、水,離子反應為Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(3)用氯氣氧化亞氯酸鈉(NaClO2)固體制備二氧化氯,還生成NaCl,反應為Cl2+2NaClO2=2ClO2+2NaCl,所以答案是:Cl2+2NaClO2=2ClO2+2NaCl;(4)①C為堿性溶液,B具有還原性,則BC中的物質可吸收氯氣,所以答案是:BC;②說明Cl2的氧化性強于I2的實驗,氯氣氧化KI生成碘,使淀粉KI試紙變藍,即濕潤淀粉碘化鉀試紙變藍能說明Cl2的氧化性強于I2 , 由于同主族元素從上到下,原子半徑依次變大,得電子能力依次減弱,氧化能力依次減弱,所以答案是:濕潤淀粉碘化鉀試紙變藍;同主族元素從上到下,原子半徑依次變大,得電子能力依次減弱,氧化能力依次減弱.
2NaOH+Cl2↑+H2↑;(2)用氯氣與燒堿溶液反應制備84消毒液,生成NaCl、NaClO、水,離子反應為Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(3)用氯氣氧化亞氯酸鈉(NaClO2)固體制備二氧化氯,還生成NaCl,反應為Cl2+2NaClO2=2ClO2+2NaCl,所以答案是:Cl2+2NaClO2=2ClO2+2NaCl;(4)①C為堿性溶液,B具有還原性,則BC中的物質可吸收氯氣,所以答案是:BC;②說明Cl2的氧化性強于I2的實驗,氯氣氧化KI生成碘,使淀粉KI試紙變藍,即濕潤淀粉碘化鉀試紙變藍能說明Cl2的氧化性強于I2 , 由于同主族元素從上到下,原子半徑依次變大,得電子能力依次減弱,氧化能力依次減弱,所以答案是:濕潤淀粉碘化鉀試紙變藍;同主族元素從上到下,原子半徑依次變大,得電子能力依次減弱,氧化能力依次減弱.
【考點精析】本題主要考查了氯氣的化學性質的相關知識點,需要掌握氯氣的化學性質:與金屬反應將金屬氧化成高價態;非金屬反應;與水反應;與堿反應;與還原性物質反應才能正確解答此題.


科目:高中化學 來源: 題型:
【題目】有機物的種類繁多,但其命名是有規則的.下列有機物命名正確的是( )
A.![]() 2﹣乙基丁烷
2﹣乙基丁烷
B.CH3CHBr2二溴乙烷
C.![]() 2﹣甲基丁烯
2﹣甲基丁烯
D.![]() 苯甲醇
苯甲醇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乳酸( ![]() )是一種獨特的調味劑,有很強的防腐、保鮮功效.常溫下乳酸為無色液體,能與水、乙醇混溶.
)是一種獨特的調味劑,有很強的防腐、保鮮功效.常溫下乳酸為無色液體,能與水、乙醇混溶.
(1)將銅絲在空氣中灼燒至表面呈黑色,趁熱伸入乳酸中,銅絲的顏色變為 , 證明乳酸分子中含有羥基.該反應的化學方程式為 .
(2)請設計實驗證明乳酸分子中含有羧基: .
(3)[CH3CH(OH)COO]2Fe(乳酸亞鐵)是一種常用的補鐵利,可通過乳酸與碳酸亞鐵反應制得.如圖裝置(加熱和夾持裝置略去)A中裝有稀硫酸,燒瓶B中裝有鐵屑,向三頸瓶C中加人碳酸亞鐵固體和乳酸溶液并加熱至75℃,將A中稀硫酸滴人B中開始反應. 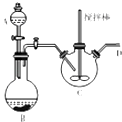
①儀器A、B組成的裝置的作用是 .
②C中發生反應的化學方程式為 .
③該實驗中尾氣處理的方法為 .
④某興趣小組用KMnO4滴定法測定樣品中Fe2+含量進而計算產品中乳酸亞鐵的質量分數,結果發現產品的質量分數總是大于100%,其原因可能是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A.NH4HSO3與足量的2 mol/L硫酸溶液混合微熱,產生的刺激性氣味的氣體是NH3
B.
用如圖所示裝置探究銅絲與過量濃硫酸的反應,為確認CuSO4生成,向①中加水,觀察顏色
C.取適量鐵粉與一定量的稀硝酸恰好完全反應,體現酸性的硝酸與體現氧化性的硝酸的物質的量之比為3:1
D.電解熔融氯化鋁制備金屬鋁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向兩份30mL同一濃度的NaOH溶液中通入CO2氣體,因CO2通入量的不同,溶液的組成也不同,得到溶液M、N.若向M、N溶液中逐滴加入濃度為0.25molL﹣1鹽酸,產生的氣體體積v(CO2)與加入鹽酸的體積v(HCl)的關系分別為如圖所示兩種情況A和B.
請回答下列問題:
(1)NaOH溶液的物質的量濃度為 .
(2)M、N兩溶液中相同組分溶質的物質的量之比為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數,下列敘述中正確的是( )
A.標準狀況下,22.4L H2中所含質子數、中子數均為2NA
B.32g O2氣體和32g O3氣體的分子數之比為3:2
C.1L 1molL﹣1的鹽酸中所含粒子總數為2NA
D.71g氯氣與足量鐵粉充分反應,轉移的電子數為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請回答:
(1)用氧化物的形式表示翡翠[NaAl(SiO3)2]的組成 .
(2)鎂燃燒不能用CO2滅火,用化學方程式表示其理由 .
(3)在NaHSO4溶液中滴加Ba(OH2)溶液至溶液呈中性,該反應的離子方程式 .
(4)寫出下列反應的化學方程式: ①煅燒黃鐵礦(FeS2);
②已知:氧化性Cl2>Br2>Fe3+ , 寫出FeBr2溶液與等物質的量Cl2反應的離子方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A是分子式為C7H8的芳香烴,已知它存在以下一系列轉化關系,其中C是一種一元醇,D是A的對位一取代物,H與E、I與F分別互為同分異構體:
(1)化合物I的結構簡式是 ,
反應B→C的化學方程式是.
(2)設計實驗證明H中含有溴原子,還需用到的試劑有.
(3)為驗證E→F的反應類型與E→G不同,下列實驗方法切實可行的是_____________.
A.向E→F反應后的混合液中加入硝酸酸化,再加入AgNO3溶液得到淡黃色沉淀
B.向E→F反應后的混合液中加入溴水,發現溴水立即褪色
C.向E→F反應后的混合液中加入鹽酸酸化后,加入溴的CCl4溶液,使之褪色
D.向E→F反應后的混合液中加入酸性KMnO4溶液,混合液紅色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X,Y,Z,M,G五種元素分屬三個短周期,且原子序數依次增大.X,Z同主族,可形成離子化合物ZX;Y,M同主族,可形成MY2、MY3兩種分子.請回答下列問題:
(1)Y在元素周期表中的位置為 .
(2)上述元素的最高價氧化物對應的水化物酸性最強的是(寫化學式),非金屬氣態氫化物還原性最強的是(寫化學式).
(3)Y、G的單質或兩元素之間形成的化合物可作水消毒劑的有(寫出其中兩種物質的化學式).
(4)ZX的電子式為;ZX與水反應放出氣體的化學方程式為 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com