
【題目】下列敘述正確的是( )
A.FeO與稀硝酸反應屬于復分解反應
B.常溫下Fe與濃硝酸不反應
C.銅片與濃硝酸發生離子反應:Cu+NO3-+4H+=Cu2++NO2↑+2H2O
D.向Fe(NO3)2稀溶液中加入鹽酸發生反應:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
科目:高中化學 來源: 題型:
【題目】在密閉容器中發生下列反應:I2(g)+H2(g)![]() 2HI(g)(正反應為放熱反應)。起始時,n(H2)=a mol,n(I2)=b mol。只改變表中列出的條件,其他條件不變,試將化學反應速率的改變填入相關的表格中(填“增大”“減小”或“不變”)。
2HI(g)(正反應為放熱反應)。起始時,n(H2)=a mol,n(I2)=b mol。只改變表中列出的條件,其他條件不變,試將化學反應速率的改變填入相關的表格中(填“增大”“減小”或“不變”)。
編號 | 改變的條件 | 反應速率 |
(1) | 升高溫度 | ______ |
(2) | 加入正催化劑 | ______ |
(3) | 再充入a mol H2 | ______ |
(4) | 將容器的容積擴大到原來的2倍 | ______ |
(5) | 保持容積不變,通入b mol Ne | ______ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在36 g碳不完全燃燒所得氣體中,CO占![]() 體積,CO2占
體積,CO2占![]() 體積。且有:
體積。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
與這些碳完全燃燒相比,損失的熱量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于平衡體系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列結論中錯誤的是
pC(g)+qD(g) ΔH<0。下列結論中錯誤的是
A. 若溫度不變,將容器的體積縮小到原來的一半,此時A的濃度為原來的2.1倍,則m+n<p+q
B. 若平衡時,A、B的轉化率相等,說明反應開始時,A、B的物質的量之比為m∶n
C. 若m+n=p+q,則往含有a mol氣體的平衡體系中再加入a mol的B,達到新平衡時,氣體的總物質的量等于2a
D. 若溫度不變時壓強增大到原來的2倍,達到新平衡時,總體積一定比原來的![]() 要小
要小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,濃度均為1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,測得其pH為9.3。下列有關敘述正確的是( )
A. 加入適量的NaCl,可使c(NH![]() )=c(Cl-)
)=c(Cl-)
B. 滴加幾滴濃氨水,c(NH![]() )減小
)減小
C. 滴加幾滴濃鹽酸,![]() 的值減小
的值減小
D. 1.0 mol·L-1的NH4Cl溶液中c(NH![]() )比該混合溶液中的大
)比該混合溶液中的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】精煉銅工業中陽極泥的綜合利用具有重要意義。一種從銅陽極泥(主要含有銅、銀、金、少量的鎳)中分離提取多種金屬元素的工藝流程如下:

已知:ⅰ分金液中含金離子主要成分為[AuCl4]-;分金渣的主要成分為AgCl;
ⅱ分銀液中含銀離子主要成分為[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分銅”時各元素的浸出率如下表所示。

(1)由表中數據可知,Ni的金屬性比Cu______。分銅渣中銀元素的存在形式為(用化學用語表示)______。“分銅”時,如果反應溫度過高,會有明顯的放出氣體現象,原因是_______。
(2)“分金”時,單質金發生反應的離子方程式為________。
(3)Na2SO3溶液中含硫微粒物質的量分數與pH的關系如圖所示。

“沉銀”時,需加入硫酸調節溶液的pH=4,分析能夠析出AgCl的原因為_______。調節溶液的pH不能過低,理由為______(用離子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉銀時為了保證不析出Ag2SO4,應如何控制溶液中SO42—濃度(假定溶液中Ag+濃度為0.1mol/L)。________。
(5)工業上,用鎳為陽極,電解0.1 mol/L NiCl2溶液與一定量NH4Cl組成的混合溶液,可得高純度的球形超細鎳粉。當其他條件一定時,NH4Cl的濃度對陰極電流效率及鎳的成粉率的影響如圖所示:
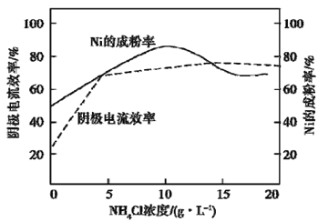
為獲得髙純度的球形超細鎳粉,NH4Cl溶液的濃度最好控制為_______g/L,當NH4Cl溶液的濃度大于15g/L時,陰極有無色無味氣體生成,導致陰極電流效率降低,該氣體為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示甲是某學生驗證銅和濃硝酸反應的裝置,乙、丙是另外兩位同學對甲裝置改進后的裝置:

(1)甲、乙、丙三個裝置中都發生的反應的化學方程式:__。
(2)和甲裝置相比,乙裝置的優點是
①__;
②__。
(3)為了進一步驗證NO2和水的反應,某學生設計了丙裝置。實驗時先關閉止水夾__,再打開止水夾__,才能使NO2氣體充滿②試管;當氣體充滿②試管后,將銅絲提起與溶液脫離。欲使燒杯中的水進入②試管,應該__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示A~E五種物質間的相互轉化關系,其中A為淡黃色固體,B為單質。回答下列問題:

(1)寫出各物質的化學式:A_____,B_____,C___,D_____,E____。
(2)寫出B→C、D→E反應的離子方程式:B→C:______;D→E:________。
(3)寫出A→D的化學方程式,并用雙線橋標出電子轉移情況________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CMU是一種熒光指示劑,可通過下列反應制備:
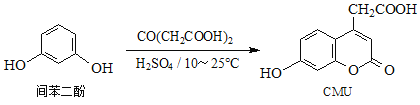
下列說法正確的是
A. 1molCMU最多可與1molBr2反應 B. 1molCMU最多可與4molNaOH反應
C. CMU在酸性條件下的水解產物只有1種 D. 可用FeCl3溶液鑒別間苯二酚和CMU
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com