
【題目】實驗室里,從廢舊鈷酸鋰離子電池的正極材料(在鋁箔上涂覆活性物質LiCoO2)中,回收鈷、鋰的操作流程如下圖所示:

回答下列問題。
(1)拆解廢舊電池獲取正極材料前,先將其浸入NaCl溶液中,使電池短路而放電,此時溶液溫度升高,該過程中能量的主要轉化方式為____。
(2)“堿浸”過程中產生的氣體是____;“過濾”所得濾液用鹽酸處理可得到氫氧化鋁,反應的化學方程式為____。
(3)“酸浸”時主要反應的離子方程式為____;若硫酸、Na2S2O3溶液用一定濃度的鹽酸替代,也可以達到“酸浸”的目的,但會產生____(填化學式)污染環境。
(4)“沉鈷”時,調pH所用的試劑是____;“沉鈷”后溶液中c(Co2+)=____。(已知:Ksp[Co(OH)2]=1.09×l0-15)
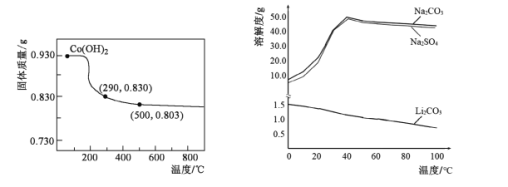
(5)在空氣中加熱Co(OH)2,使其轉化為鈷的氧化物。加熱過程中,固體質量與溫度的關系如左下圖所示。290~500℃,發生反應的化學方程式為____。
(6)根據右下圖判斷,“沉鋰”中獲得Li2CO3固體的操作主要包括____、____、洗滌、干燥等步驟。
【答案】化學能→電能→熱能 H2 NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ 8LiCoO2+ S2O32-+22H+=8Li++8Co2++2SO42-+11H2O Cl2 NaOH溶液或氫氧化鈉固體 1.09×l0-6mol/L 6Co2O3![]() 4Co3O4+ O2↑ 蒸發濃縮 趁熱過濾
4Co3O4+ O2↑ 蒸發濃縮 趁熱過濾
【解析】
正極材料主要由Al和LiCoO2組成,LiCoO2屬于鹽類,由復分解反應的條件可判斷,其與NaOH溶液混合不發生反應,故“堿浸”過程中只有Al和NaOH反應生成偏鋁酸鈉和氫氣,過濾得到濾渣為LiCoO2;“酸浸”時反應物有LiCoO2、硫酸和Na2S2O3溶液,依據“沉鈷”產物為Co(OH)2可判斷,反應后鈷元素的價態從+3價降為+2價,依據氧化還原反應規律以及工藝中最后還可獲得Na2SO4·10H2O副產品,可推知S元素價態升高并轉化為SO42-;之后調節pH值得到Co(OH)2沉淀,再加入碳酸鈉溶液調節pH值沉鋰,得到碳酸鋰和母液,母液結晶得到Na2SO4·10H2O。
(1)依據“電池短路而放電”“溶液溫度升高”兩項信息,即可判斷廢舊電池的處理過程中能量的主要轉化方式為化學能→電能→熱能;
(2)依題中信息可知,正極材料主要由Al和LiCoO2組成,LiCoO2屬于鹽類,由復分解反應的條件可判斷,其與NaOH溶液混合不發生反應,故“堿浸”過程中只有Al和NaOH反應,生成NaAlO2和H2;“過濾”所得濾液用適量鹽酸處理可以得到氫氧化鋁,方程式為NaAlO2+HCl+H2O=NaCl+Al(OH)3↓;
(3)根據分析可知“酸浸”時Na2S2O3被氧化為SO42-,Co元素被還原,結合電子守恒和元素守恒可知離子反應方程式為:8LiCoO2+ S2O32-+22H+=8Li++8Co2++2SO42-+11H2O;加入的Na2S2O3 起還原作用,用一定濃度的鹽酸替代“Na2S2O3溶液和硫酸”,也能實現酸浸目的,可知該反應中,鹽酸也起了還原劑的作用,氧化產物為會污染環境的Cl2;
(4)結合“沉鋰”后母液中還可以獲得Na2SO4·10H2O,可知用的試劑為NaOH溶液或固體;溶液pH=9.5,則溶液中c(OH-)=10-4.5mol/L,帶入Ksp[Co(OH)2]= c2(OH-)·c(Co2+)=1.09 ×l0-15求得c(Co2+)=1.09×l0-6mol/L;
(5)從圖中信息可知,加熱前的反應物為Co(OH)2 (0.930g) ,其物質的量為0.01mol,依據鈷元素的量不變可知: n(Co)=0.01 mol, m(Co)=0.590g,溫度升溫290℃時,轉化為0.830g某種鈷的氧化物,該氧化物中,n(O)=![]() =0.015mol,由此可以確定該氧化物為Co2O3;同理可以確定500℃時,n(O)=
=0.015mol,由此可以確定該氧化物為Co2O3;同理可以確定500℃時,n(O)=![]() ≈0.0133mol,則生成的氧化物為Co3O4;所以290℃~500℃過程中,Co2O3轉化為Co3O4,反應過程中,Co元素化合價降低。氧元素化合價升高并轉化為O2,故反應的化學方程式為6Co2O3
≈0.0133mol,則生成的氧化物為Co3O4;所以290℃~500℃過程中,Co2O3轉化為Co3O4,反應過程中,Co元素化合價降低。氧元素化合價升高并轉化為O2,故反應的化學方程式為6Co2O3![]() 4Co3O4+ O2↑;
4Co3O4+ O2↑;
(6)分析溶解度曲線可知LiCO3微溶,其溶解度隨溫度升高而降低,為了提高鋰元素的回收率,同時防止硫酸鈉析出,應采用蒸發濃縮(減少溶劑)并在較高溫度下趁熱過濾等操作。


科目:高中化學 來源: 題型:
【題目】根據下列實驗操作和現象所得到的結論正確的是( )
選項 | 實驗操作和現象 | 實驗結論 |
A | 向0.1mol/L碳酸鈉溶液中滴入酚酞,溶液變紅,加熱,紅色加深。 | 碳酸鈉屬于弱堿 |
B | 測定醋酸溶液pH,用玻璃棒蘸取溶液,點在pH試紙上,試紙顯紅色。 | 醋酸溶液顯酸性 |
C | 將銅片和鋅片用導線相連,插入CuSO4溶液中,鋅片質量減小,銅片質量增加。 | 鋅被還原 |
D | 向氯化銀的濁液中滴入KI溶液,濁液中的固體由白色變為黃色。 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知可逆反應X(g)+2Y(g)![]() 3Z(g) ΔH<0,一定溫度下,在體積為2 L的密閉容器中加入4molY和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法不正確的是
3Z(g) ΔH<0,一定溫度下,在體積為2 L的密閉容器中加入4molY和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法不正確的是
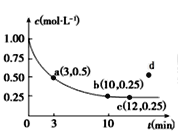
A.若向該容器中加入1molX、2molY,達平衡時,X的平衡濃度等于0.125mol/L
B.a點正反應速率大于逆反應速率
C.反應達平衡時,降低溫度不能實現c到d的轉化
D.該條件下,反應達平衡時,平衡常數K=3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究電化學原理與應用有非常重要的意義。
(1)鋅錳電池(俗稱干電池) 是一種一次電池,生活中應用廣泛。
①鋅錳電池負極上的電極反應式為:______________________________。
②與普通(酸性)鋅錳電池相比較,堿性鋅錳電池的優點是____________________(回答一條即可)。
(2)鉛蓄電池是最常見的二次電池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充電時陰極反應為:________________________________________。
②用鉛蓄電池為電源進行電解飽和食鹽水實驗(石墨棒為陽極,鐵為陰極,食鹽水500mL,溫度為常溫),當電路中有0.05mol電子轉移時,食鹽水的pH為______(假設溶液體積不變,產物無損耗)。
(3)圖1是金屬(M)-空氣電池的工作原理,我國首創的海洋電池以鋁板為負極,鉑網為正極,海水為電解質溶液,電池反應為:___________________________ 。

二氧化硫—空氣質子交換膜燃料電池實現了制硫酸、發電、環保三位一體的結合,原理如圖2所示。Pt2上的電極反應式為:_______________________________________ 。
(4)高鐵酸鈉(Na2FeO4)易溶于水,是一種新型多功能水處理劑,可以用電解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如圖所示。
FeO42+3H2↑,工作原理如圖所示。

裝置通電后,鐵電極附近生成紫紅色的FeO42,鎳電極有氣泡產生。電解一段時間后,c(OH)降低的區域在_____________(填“陰極室”或“陽極室”);陽極反應為:___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA是阿伏加德羅常數的值,下列說法正確的是
A.1 mol·L-1鹽酸中,Cl-數為NA
B.58 g正丁烷中,共價鍵數為10 NA
C.常溫常壓下,2. 24 L O2中氧分子數為0.2NA
D.密閉容器中,3 mol H2和1 mol N2充分反應后原子數為8NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫及其化合物對人類的生產和生活有著重要的作用.
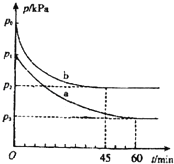
2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1是制備硫酸的重要反應.
(1)在容積為V L的密閉容器中起始充入2mol SO2和1mol O2,反應在不同條件下進行,反應體系總壓強隨時間的變化如圖所示.與實驗a相比,實驗b改變的條件是 ,判斷的依據 .
(2)二氧化硫在一定條件下還可以發生如下反應:
SO2(g)+NO2(g)SO3(g)+NO(g)△H=﹣42kJmol﹣1.
在1L恒容密閉容器中充入SO2(g)和NO2(g),所得實驗數據如下:
實驗編號 | 溫度 | 起始時物質的量/mol | 平衡時物質的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①實驗甲中,若2min時測得放出的熱量是4.2kJ,則0~2min時間內,用SO2(g)表示的平均反應速率v(SO2)= ,該溫度下的平衡常數 .
②實驗丙中,達到平衡時,NO2的轉化率為 .
③由表中數據可推知,Tl T2(填“>”“<’’或“=”),判斷的理由是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A.往碘化亞鐵中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.氯氣與水反應:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.硝酸銀溶液中加入過量氨水:Ag+ +NH3·H2O=AgOH↓+NH4+
D.Ca(HCO3)2溶液與少量NaOH溶液反應:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋是一個巨大的化學資源寶庫,海水資源綜合利用的部分流程圖。
![]()
(1)由海水提取的粗鹽中常含有![]() 等,可以加入_______________(填化學式)除去,反應的離子方程式為__________________。
等,可以加入_______________(填化學式)除去,反應的離子方程式為__________________。
(2)步驟①反應的離子方程式為__________________。
(3)步驟②中溴單質被SO2還原為![]() ,硫元素被氧化為
,硫元素被氧化為![]() ,從該反應原理中不能得出溴的非金屬性強于硫,其原因是__________________。當有0.25 mol SO2被氧化,轉移的電子的物質的量為__________mol。
,從該反應原理中不能得出溴的非金屬性強于硫,其原因是__________________。當有0.25 mol SO2被氧化,轉移的電子的物質的量為__________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于化合物 ,下列敘述正確的是( )
,下列敘述正確的是( )
A. 分子間可形成氫鍵 B. 分子中既有極性鍵又有非極性鍵
C. 分子中有7個σ鍵和1個π鍵 D. 該分子在水中的溶解度小于2丁烯
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com