
【題目】某同學設計實驗證明銅與濃硫酸能發生反應,并檢驗生成氣體的性質,如圖所示,在試管里加入2mL濃硫酸,用帶導管和一個小孔的膠管塞緊,從孔中插入一根銅絲,加熱,把放出的氣體依次通入品紅溶液和石蕊溶液中. 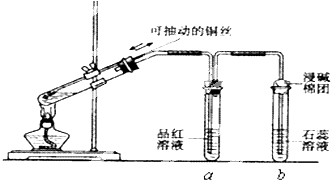
請回答下列問題:
(1)寫出銅與濃硫酸反應的化學方程式: .
(2)試管a、b分別檢驗生成氣體的性質,寫出觀察到的現象及其作用.試管a中的現象是 , 作用是 . 試管b中的現象是 , 作用是 .
(3)裝置中浸堿面團的作用是 .
(4)如圖將銅絲改為可抽動的銅絲符合化學實驗“綠色化”的原因是 .
【答案】
(1)Cu+2H2SO4(濃) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
(2)品紅溶液褪色;證明二氧化硫具有漂白性;紫色石蕊試液變紅;證明二氧化硫溶于水顯示酸性
(3)吸收多余的二氧化硫,防止污染大氣
(4)通過調節銅絲的高度,可以可知參加反應的銅與濃硫酸的接觸面積,從而可知二氧化硫產生的量,減少二氧化硫的污染
【解析】解:(1)銅跟濃硫酸反應,銅具有還原性,濃硫酸具有強氧化性,反應必須加熱才能發生,書寫化學方程式時注意“濃”字,反應的化學方程式為:Cu+2H2SO4(濃) ![]() CuSO4+2H2O+SO2↑, 故答案為:Cu+2H2SO4(濃)
CuSO4+2H2O+SO2↑, 故答案為:Cu+2H2SO4(濃) ![]() CuSO4+2H2O+SO2↑;(2)二氧化硫具有漂白性,能夠使品紅溶液褪色,所以試管a中品紅溶液褪色,目的是證明二氧化硫具有漂白性;二氧化硫屬于酸性氧化物,溶于水后溶液顯示酸性,能夠使紫色的石蕊試液變紅,
CuSO4+2H2O+SO2↑;(2)二氧化硫具有漂白性,能夠使品紅溶液褪色,所以試管a中品紅溶液褪色,目的是證明二氧化硫具有漂白性;二氧化硫屬于酸性氧化物,溶于水后溶液顯示酸性,能夠使紫色的石蕊試液變紅,
故答案為:品紅溶液褪色;證明二氧化硫具有漂白性;紫色石蕊試液變紅;證明二氧化硫溶于水顯示酸性;(3)二氧化硫是一種有毒氣體,多余的二氧化硫不能直接排放到空氣中,應該用堿液吸收,
故答案為:吸收多余的二氧化硫,防止污染大氣;(4)將銅絲改為可抽動的銅絲后,通過調節銅絲的高度,可以可知參加反應的銅與濃硫酸的接觸面積,從而可知二氧化硫產生的量,減少二氧化硫的污染,該方法符合綠色化學的理念,
故答案為:通過調節銅絲的高度,可以可知參加反應的銅與濃硫酸的接觸面積,從而可知二氧化硫產生的量,減少二氧化硫的污染.
(1)銅與濃硫酸反應生成硫酸銅、二氧化硫氣體和水,據此寫出反應的化學方程式;(2)二氧化硫具有漂白性,能夠使品紅溶液褪色;二氧化硫為酸性氧化物,溶于水顯示酸性;(3)二氧化硫有毒,不能直接排放,可以用堿液吸收;(4)通過調節銅絲的高度,可以控制反應的開始與結束,減少了污染氣體的排放、節約了原料.


科目:高中化學 來源: 題型:
【題目】埋在下列土壤中的鑄鐵輸油管道,腐蝕速率最慢的是( )
A.氧化鐵較多的酸性土壤B.潮濕疏松的中性土壤
C.碳顆粒較多的堿性土壤D.干燥致密的中性土壤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三硫化磷(P4S3)是黃綠色針狀晶體,易燃、有毒,分子結構之一如下圖所示,己知其燃燒熱ΔH=-3677kJ/mol(P被氧化為P4O10),下列有關P4S3 的說法中不正確的是
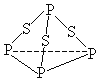
A. P4S3中磷元素為+3價
B. 分子中每個原子最外層均達到8電子穩定結構
C. 熱化學方程式為P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/mol
D. 分子中存在極性鍵與非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于人體所需的基本營養物質的說法不正確的是
A. 在人體內,油脂的主要反應是在脂肪酶催化下水解為高級脂肪酸和甘油
B. 加酶洗衣粉中的酶其實是蛋白質
C. 糖類、油脂、蛋白質都能在一定條件下發生水解反應
D. 糖類都由C、H、O三種元素組成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某金屬與氯氣反應生成的化合物中,其質量比為1∶1.9,原子個數比為1∶3,則金屬的相對原子質量為
A. 27 B. 56 C. 23 D. 64
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA 為阿伏加德羅常數的值。下列說法正確的是
A. 標準狀況下,11.2 L苯中所含C-H鍵數目為3NA
B. 7.8g Na2S和Na2O2組成的混合物,所含陰離子總數為0.1NA
C. 1 mol Cl2發生反應時,轉移的電子數一定為2NA
D. 常溫下,pH=2的H2SO4溶液中所含H+數目為0.01NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關對金屬和金屬材料的認識不正確的是( )
A. 鐵有良好的導熱性,常用來制作炊具
B. 合金的硬度一般小于成分金屬的硬度
C. 廢舊電池中的回收,可減少對環境的污染
D. 鋁表面易形成致密的氧化膜,可阻止鋁進一步被氧化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com