
【題目】![]() 作為一種重要化工原料,被大量應用于工業生產,與其有關性質反應的催化劑研究曾被列入國家863計劃。
作為一種重要化工原料,被大量應用于工業生產,與其有關性質反應的催化劑研究曾被列入國家863計劃。
(1)催化劑常具有較強的選擇性,即專一性。已知:
反應I:![]()
反應II:![]()
寫出NO分解生成![]() 與
與![]() 的熱化學方程式______。
的熱化學方程式______。
(2)在恒溫恒容裝置中充入一定量的![]() 和
和![]() ,在某催化劑的作用下進行反應I,測得不同時間的
,在某催化劑的作用下進行反應I,測得不同時間的![]() 和
和![]() ,的濃度如表:
,的濃度如表:
時間 | 0 | 5 | 10 | 15 | 20 | 25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
則下列有關敘述中正確的是______。
A.使用催化劑時,可降低該反應的活化能,加快其反應速率
B.若測得容器內![]() 時,說明反應已達平衡
時,說明反應已達平衡
C.當容器內![]() 時,說明反應已達平衡
時,說明反應已達平衡
D.前10分鐘內的平均速率![]()
![]()
(3)氨催化氧化時會發生上述兩個競爭反應I、![]() 為分析某催化劑對該反應的選擇性,在1L密閉容器中充入1mol
為分析某催化劑對該反應的選擇性,在1L密閉容器中充入1mol![]() 和2mol
和2mol![]() ,測得有關物質的量關系如圖1:
,測得有關物質的量關系如圖1:

①該催化劑在低溫時選擇反應______![]() 填“I”或“II”
填“I”或“II”![]() 。
。
②![]() 時,
時,![]() 的平衡常數
的平衡常數![]() ______
______![]() 不要求得出計算結果,只需列出數字計算式
不要求得出計算結果,只需列出數字計算式![]() 。
。
③![]() 點比B點所產生的NO的物質的量少的主要原因______。
點比B點所產生的NO的物質的量少的主要原因______。
(4)合成氨工業會產生大量副產物![]() ,工業上常用高濃度的
,工業上常用高濃度的![]() 溶液吸收
溶液吸收![]() ,得溶液X,再利用電解法使
,得溶液X,再利用電解法使![]() 溶液再生,其裝置如圖2所示:
溶液再生,其裝置如圖2所示:
①在陽極區發生的反應包括______和![]() 。
。
②簡述![]() 在陰極區再生的原理______。
在陰極區再生的原理______。
(5)制備催化劑時常產生一定的廢液,工業上常利用氫硫酸檢測和除去廢液中的![]() 。
。
已知:![]() 時,
時,![]() ,
,![]() ,
,![]()
①在計算溶液中的離子濃度時,涉及弱酸的電離通常要進行近似處理。則![]() 氫硫酸的
氫硫酸的![]() ______
______![]() 取近似整數
取近似整數![]() 。
。
②已知,某廢液接近于中性,若加入適量的氫硫酸,當廢液中![]() ______
______![]() 計算結果保留兩位有效數字
計算結果保留兩位有效數字![]() ,就會產生CuS沉淀。
,就會產生CuS沉淀。
【答案】![]() AD Ⅱ
AD Ⅱ ![]() 該反應為放熱反應,當溫度升高,平衡向左
該反應為放熱反應,當溫度升高,平衡向左![]() 逆反應
逆反應![]() 移動
移動 ![]() 溶液中
溶液中![]() 存在電離平衡
存在電離平衡![]() ,陰極
,陰極![]() 放電使得
放電使得![]() 減小導致
減小導致![]() 的電離平衡右移,
的電離平衡右移,![]() 再生 4
再生 4 ![]()
【解析】
![]() 已知:反應I:
已知:反應I:![]()
![]()
![]() ,反應 II:
,反應 II:![]()
![]()
![]() ,根據蓋斯定律,由
,根據蓋斯定律,由![]() Ⅱ
Ⅱ![]() Ⅰ
Ⅰ![]() 可得
可得![]() ,據此可計算
,據此可計算![]() 并寫出此反應的熱化學方程式;
并寫出此反應的熱化學方程式;
![]() 催化劑改變反應途徑,降低反應活化能;
催化劑改變反應途徑,降低反應活化能;
B.不同物質表示的正、逆反應速率之比等于化學計量數之比時,反應達到平衡狀態;
C.當反應達到平衡狀態時,正、逆反應速率相等,各物質的濃度、百分含量不變;
D.![]() 據此進行計算;
據此進行計算;
![]() 根據生成物氮氣、NO的物質的量判斷催化劑對反應的選擇性;
根據生成物氮氣、NO的物質的量判斷催化劑對反應的選擇性;
![]() 平衡時
平衡時![]() ,利用方程式計算兩個反應消耗的氨氣、氧氣物質的量以及生成的水的物質的量,可以計算平衡時氨氣與氧氣物質的量,由于容器體積為1L,利用物質的量代替濃度帶入
,利用方程式計算兩個反應消耗的氨氣、氧氣物質的量以及生成的水的物質的量,可以計算平衡時氨氣與氧氣物質的量,由于容器體積為1L,利用物質的量代替濃度帶入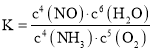 計算;
計算;
![]() 的溫度較高,抑制平衡正向移動;
的溫度較高,抑制平衡正向移動;
![]() 陽極區發生的反應為氧化反應,為失電子的反應,考慮到溶液為堿性介質,則為
陽極區發生的反應為氧化反應,為失電子的反應,考慮到溶液為堿性介質,則為![]() 放電生成
放電生成![]() 和
和![]() ,據此寫出陽極的電極反應式;
,據此寫出陽極的電極反應式;
![]() 在陰極區再生,考慮
在陰極區再生,考慮![]() 存在電離平衡,產生
存在電離平衡,產生![]() 和
和![]() ,
,![]() 在陰極放電使溶液
在陰極放電使溶液![]() 減小,促使
減小,促使![]() 的電離平衡右移產生更多的
的電離平衡右移產生更多的![]() ;
;
![]() 氫硫酸是二元弱酸,其一級電離是主要的,
氫硫酸是二元弱酸,其一級電離是主要的,![]() ,
,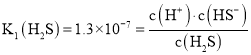 ,由此計算
,由此計算![]() 及溶液的pH;
及溶液的pH;
![]() 溶液中
溶液中![]() 為
為![]() ,根據
,根據![]() ,計算
,計算![]() 。
。
![]() 依據蓋斯定律,結合反應I:
依據蓋斯定律,結合反應I:![]()
![]()
![]() ,反應 II:
,反應 II:![]()
![]()
![]() ,由
,由![]() Ⅱ
Ⅱ![]() Ⅰ
Ⅰ![]() 可得
可得![]() ,則
,則![]()
![]() ,此反應的熱化學方程式為
,此反應的熱化學方程式為![]()
![]() ;
;
![]() .加入催化劑,改變反應途徑,降低反應的活化能,增加了活化分子百分數,化學反應速率增大,故A正確;
.加入催化劑,改變反應途徑,降低反應的活化能,增加了活化分子百分數,化學反應速率增大,故A正確;
B.對于反應![]() ,應是
,應是 ![]() 時,反應達到平衡狀態,故B錯誤;
時,反應達到平衡狀態,故B錯誤;
C.當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,因平衡常數未知,則![]() 不能確定是否平衡,故 C錯誤;
不能確定是否平衡,故 C錯誤;
D.![]()
![]()
![]() ,
,![]() ,據方程式
,據方程式![]() 和NO前系數相等,則反應速率也相等,故
和NO前系數相等,則反應速率也相等,故![]() ,故D正確;
,故D正確;
故答案為:AD;
![]() 由圖可知,該催化劑在高溫時,生成的NO物質的量遠大于氮氣的,故該催化劑在高溫下選擇反應I,低溫時選擇反應II;
由圖可知,該催化劑在高溫時,生成的NO物質的量遠大于氮氣的,故該催化劑在高溫下選擇反應I,低溫時選擇反應II;
![]() 在 1L密閉容器中充入
在 1L密閉容器中充入 ![]() 和
和 ![]() ,
,![]() 平衡時
平衡時![]() ,則:在
,則:在 ![]() 中變化的物質的量依次是
中變化的物質的量依次是![]() :0.2、0.25、0.2、03;在
:0.2、0.25、0.2、03;在![]() 中變化的物質的量依次是
中變化的物質的量依次是![]() :0.4、0.3、0.2、06;故平衡時,
:0.4、0.3、0.2、06;故平衡時,![]() ,
,![]() ,
,![]() ,由于容器體積為1L,利用物質的量代替濃度計算平衡常數
,由于容器體積為1L,利用物質的量代替濃度計算平衡常數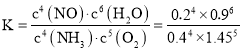 ;
;
![]() 正反應放熱,升高溫度平衡逆向移動,則C的溫度較高,抑制平衡正向移動,NO的物質的量較少;
正反應放熱,升高溫度平衡逆向移動,則C的溫度較高,抑制平衡正向移動,NO的物質的量較少;
![]() 陽極區發生的反應為氧化反應,為失電子的反應,考慮到溶液為堿性介質,則為
陽極區發生的反應為氧化反應,為失電子的反應,考慮到溶液為堿性介質,則為![]() 放電生成
放電生成![]() 和
和![]() ,則陽極區發生的電極反應有:
,則陽極區發生的電極反應有:![]() ;
;
![]() 在陰極區再生,考慮
在陰極區再生,考慮![]() 存在電離平衡,產生
存在電離平衡,產生![]() 和
和![]() ,
,![]() 在陰極放電使溶液
在陰極放電使溶液![]() 減小,促使
減小,促使![]() 的電離平衡右移產生更多的
的電離平衡右移產生更多的![]() ,因此
,因此![]() 在陰極區再生的原理可以認為是:溶液中
在陰極區再生的原理可以認為是:溶液中![]() 存在電離平衡
存在電離平衡![]() ,陰極
,陰極![]() 放電使得
放電使得![]() 減小導致
減小導致![]() 的電離平衡右移,
的電離平衡右移,![]() 再生;
再生;
![]() 氫硫酸是二元弱酸,其一級電離是主要的,
氫硫酸是二元弱酸,其一級電離是主要的,![]() ,設
,設![]() ,則
,則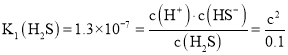 ,解得
,解得![]() ,及溶液的
,及溶液的![]() ;
;
![]() 溶液中
溶液中![]() 為
為![]() ,根據
,根據![]() ,可知
,可知![]() 。
。


科目:高中化學 來源: 題型:
【題目】工業上用CO生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g)![]() CH3OH(g)。圖1表示反應中能量的變化;圖2表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。
CH3OH(g)。圖1表示反應中能量的變化;圖2表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。
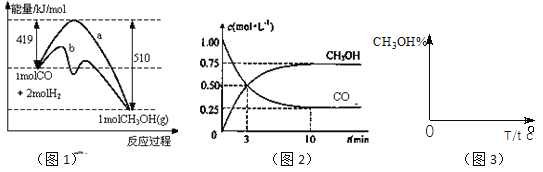
請回答下列問題:
(1)在“圖1”中,曲線___(填:a或b)表示使用了催化劑;該反應屬于_____(填:吸熱、放熱)反應。
(2)下列說法正確的是_____
A.起始充入的CO為2mol
B.增加CO濃度,CO的轉化率增大
C.容器中壓強恒定時,反應已達平衡狀態
D.保持溫度和密閉容器容積不變,再充入1molCO和2molH2,再次達到平衡時
n(CH3OH)/n(CO)會減小
(3)從反應開始到建成平衡, v(H2)=________;已知:在一定溫度下,當一個可逆反應達到化學平衡時,生成物濃度冪之積與反應物濃度冪之積的比值是一個常數,這個常數就是該反應的化學平衡常數,那么在該溫度下CO(g)+2H2(g)![]() CH3OH(g)的化學平衡常數為_______________。若保持其它條件不變,將反應體系升溫,則該反應化學平衡常數____(填“增大”、“減小”或“不變”)。
CH3OH(g)的化學平衡常數為_______________。若保持其它條件不變,將反應體系升溫,則該反應化學平衡常數____(填“增大”、“減小”或“不變”)。
(4)請在“圖3”中畫出平衡時甲醇百分含量(縱坐標)隨溫度(橫坐標)變化的曲線,要求畫壓強不同的2條曲線________(在曲線上標出P1、P2,且P1<P2)。
(5) 有一類甲醇質子交換膜燃料電池,需將甲醇蒸氣轉化為氫氣,兩種反應原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,請寫出32g的CH3OH(g)完全燃燒生成液態水的熱化學方程式____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是引起“溫室效應”的主要物質,節能減排,高效利用化石能源,控制
是引起“溫室效應”的主要物質,節能減排,高效利用化石能源,控制![]() 排放,探索
排放,探索![]() 的循環利用是保護環境,促進經濟科持續發展的重要舉措.
的循環利用是保護環境,促進經濟科持續發展的重要舉措.
(1)在一定溫度下,向2L固定容積的密閉容器中通入2mol![]() ,3mol
,3mol![]() ,發生反應為:
,發生反應為:![]() ,測得
,測得![]() 和
和![]() 的濃度隨時間變化如圖1所示.
的濃度隨時間變化如圖1所示.
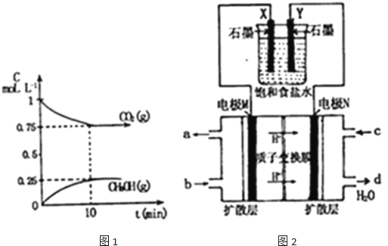
①能說明該反應已達到平衡狀態的是 ______
A.![]() 體積分數在混合氣體中保持不變
體積分數在混合氣體中保持不變
B.單位時間內有![]()
![]() 斷裂,同時有
斷裂,同時有![]()
![]() 鍵生成
鍵生成
C.混合氣體的密度不隨時間變化
D.當體系中![]() :
:![]() :l,且保持不變
:l,且保持不變
②下列措施能使![]() 增大的是 ______
增大的是 ______
A.升高溫度 ![]() 恒溫恒容充入
恒溫恒容充入![]()
![]() 使
使![]() 變成
變成![]()
D.恒溫恒容下,再充入2mol![]() ,3mol
,3mol![]()
③計算該溫度下此反應的平衡常數![]() ______ ;若使
______ ;若使![]() 應采取的措施是 ______
應采取的措施是 ______
A.增大壓強![]() 恒壓加入一定量
恒壓加入一定量![]() C.恒容通入
C.恒容通入![]() D.降低溫度
D.降低溫度![]() 升高溫度
升高溫度
(2)如圖2所示:用某甲醇燃料電池作電源電解飽和食鹽水.
①寫出電極N發生的反應式: ______
②若食鹽水體積為300Ml,電解過程溶液體積變化忽略不計,常溫下測得![]() 時,理論上消耗甲醇質量為 ______
時,理論上消耗甲醇質量為 ______ ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1)實驗室中常用NaOH溶液來進行洗氣和提純,當100mL![]() 的NaOH溶液吸收標準狀況下
的NaOH溶液吸收標準狀況下![]()
![]() 時,所得溶液中各離子濃度由大到小的順序為______
時,所得溶液中各離子濃度由大到小的順序為______
(2)常溫下向一定體積的![]() 醋酸溶液中加水稀釋后,下列說法正確的是______.
醋酸溶液中加水稀釋后,下列說法正確的是______.
A.溶液中導電粒子的數目減少 ![]() 醋酸的電離程度增大,
醋酸的電離程度增大,![]() 亦增大
亦增大
C.溶液中 不變
不變 ![]() 溶液中
溶液中 減小
減小
(3)①常溫下將![]() 稀硫酸
稀硫酸![]() 與
與![]() NaOH溶液
NaOH溶液![]() mL棍合,所得溶液的pH為1,則
mL棍合,所得溶液的pH為1,則![]() :
:![]() ______
______![]() 溶液體積變化忽略不詢.
溶液體積變化忽略不詢.
②常溫下若溶液由![]() 的HA溶液
的HA溶液![]() 與
與![]() 的NaOH溶液
的NaOH溶液![]() 混合而得,則下列說法正確的是______
混合而得,則下列說法正確的是______
A.若反應后溶液呈中性,則![]()
B.若![]() ,反應后溶液pH一定等于7
,反應后溶液pH一定等于7
C.若反應后溶液呈酸性,則![]() 一定大于
一定大于![]()
D.若反應后溶液呈堿性,則![]() 一定小于
一定小于![]()
(4)常溫下,濃度均為![]() 的下列五種溶液的pH值如下表所示:
的下列五種溶液的pH值如下表所示:
溶質 |
|
|
| NaClO | NaCN |
pH |
|
|
|
|
|
①根據表中數據,將濃度均為![]() 的下列四種酸的溶液分別稀釋100倍,pH變化最小的是______
的下列四種酸的溶液分別稀釋100倍,pH變化最小的是______
A.HCN![]()
![]()
![]()
②根據以上數據,判斷下列反應可以成立的是______.
A.![]()
![]()
C.![]()
![]()
(5)幾種離子開始沉淀時的pH如下表:
離子 |
|
|
|
pH |
|
|
|
當向含相同濃度![]() 、
、![]() 、
、![]() 離子的溶液中滴加NaOH溶液時,______
離子的溶液中滴加NaOH溶液時,______![]() 填離子符號
填離子符號![]() 先沉淀,
先沉淀,![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】膳食纖維具有突出的保健功能,近年來受到人們的普遍關注,被世界衛生組織稱為人體的“第七營養素”。木質素是一種非糖類膳食纖維,其單體之一是芥子醇,結構簡式如圖所示。下列有關芥子醇的說法正確的是( )

A.芥子醇的分子式是C11H12O4
B.芥子醇能發生水解反應
C.芥子醇分子中所有原子不可能在同一平面
D.1 mol芥子醇能與足量溴水反應消耗3 mol Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是反應A(g) + 3B(g) 2C(g) + 2D(g) 在四種不同情況下的反應速率,反應速率最大的是
A. υ(A)=0.45mol·L-1·s-1B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.45mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值,下列有關敘述正確的是
A. 標準狀況下,5.6L 一氧化氮和5.6L 氧氣混合后的分子總數為0.5NA
B. 等體積、濃度均為1mol/L的磷酸和鹽酸,電離出的氫離子數之比為3:1
C. 一定溫度下,1L 0.50 mol/L NH4Cl溶液與2L 0.25 mol/L NH4Cl溶液含NH4+的物質的量不同
D. 標準狀況下,等體積的N2和CO所含的原子數均為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列各實驗裝置的敘述中,不正確的是( )

A. 裝置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等氣體
B. 裝置③中X若為CCl4,可用于吸收NH3或HCl,并防止倒吸
C. 裝置①可用于分離C2H5OH和H2O的混合物
D. 裝置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度為![]() 時,在三個容積均為
時,在三個容積均為![]() 的恒容密閉容器中僅發生反應:
的恒容密閉容器中僅發生反應:![]() 正反應吸熱
正反應吸熱![]() 。實驗測得:
。實驗測得:![]() ,
,![]() ,
,![]() 、
、![]() 為速率常數,受溫度影響。平衡常數
為速率常數,受溫度影響。平衡常數![]() 是用平衡分壓代替平衡濃度計算,分壓
是用平衡分壓代替平衡濃度計算,分壓![]() 總壓
總壓![]() 物質的量分數。下列說法不正確的是
物質的量分數。下列說法不正確的是![]()
![]()
容器 編號 | 物質的起始濃度 | 物質的平衡濃度 | ||
|
|
|
| |
Ⅰ |
| 0 | 0 |
|
Ⅱ |
|
|
| |
Ⅲ | 0 |
|
| |
A.達平衡時,容器Ⅱ中![]() 比容器Ⅰ中的小
比容器Ⅰ中的小
B.容器Ⅱ反應達平衡前,![]()
C.起始時容器Ⅰ中總壓強為![]() ,則
,則![]() 時該反應的平衡常數
時該反應的平衡常數![]() kPa
kPa
D.當溫度改變為![]() 時,若
時,若![]() 則
則![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com