
【題目】(一)鎵、硒、硅等元素的化合物是生產第三代太陽能電池的重要材料。已知:SeO2在常溫下是白色的晶體,熔點為340-350℃,則SeO2晶體屬于____晶體,SeO2中Se原子采取的雜化類型為___。
(二)A、X、Y、Z、W、M、G等原子序數一次增大的前四周期元素
元素 | 相關信息 |
A | 原子核外電子總數與其周期數相同 |
X | 其羞態原子的L層中有3個未成對電子 |
Y | 荃態原子的2p軌道上有一個電子的自旋方向與2p軌道上其它電子的自旋方向相反 |
Z | 原子核外p電子數比s電子數多l個 |
W | 原子的第一至第四電離能(kJ·mol-1)分別是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族數與周期數相差4 |
G | 其基態原子最外層電子數為1,其余各電子層均充滿電子 |
(1)畫出W基態原子的核外電子排布圖______。
(2)A2Y的VSEPR模型名稱為____。
(3)已知為X2Y分子中Y原子只與一個X原子相連,請根據等電子原理,寫出X2Y的電子式____。
(4)X、G形成的某種化合物的晶胞結構如圖所示,則其化學式為______。

(5)已知Z和M形成的化合物的晶體密度為pg·cm-3,阿伏加德羅常效為NA,該晶體中兩個距離最近的Z離子中心間距離為_____cm。
【答案】分子 sp2 ![]() 四面體
四面體 ![]() Cu3N
Cu3N 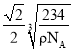
【解析】
(1)SeO2在常溫下是白色的晶體,熔點為340-350℃,熔點低,為分子晶體,SeO2中Se原子價層電子對=2+![]() (6-2×2)=3,Se原子采取的雜化類型為sp2雜化,故答案為:分子,sp2。
(6-2×2)=3,Se原子采取的雜化類型為sp2雜化,故答案為:分子,sp2。
(二)有A、X、Y、Z、W、M、G等原子序數依次增大的前四周期元素,A原子核外電子總數與其周期數相同,則A是H;X基態原子的L層中有3個未成對電子,所以X是N;Y基態原子的2p軌道上有一個電子的自旋方向與2p軌道上其它電子的自旋方向相反,所以Y是O;Z原子核外p電子數比s電子數多l個,則Z是Na;W原子的第一至第四電離能(kJ·mol-1)分別是:I1=578,I2=1817,I3=2745,I4=11575,這說明最高價是+3價,則W是Al;M元素的主族數與周期數相差4,則M是Cl;G基態原子最外層電子數為1,其余各電子層均充滿電子,因此G是Cu。
(1)基態鋁原子的核外電子數是13,則其核外電子排布圖為![]() ,故答案為:
,故答案為:![]() 。
。
(2)H2O分子中O的價層電子對數=2+(6-2×1)/2=4,所以VSEPR模型名稱為四面體,故答案為:四面體。
(3)已知為N2O分子中O原子只與一個N原子相連,與CO2互為等電子體,則其電子式為![]() ,故答案為:
,故答案為:![]() 。
。
(4)根據晶胞結構可知N原子個數=8×1/8=1,Cu原子個數=12×1/4=3,因此其化學式為Cu3N,故答案為:Cu3N。
(5)氯化鈉晶體密度為pg·cm-3,阿伏加德羅常效為NA,該晶體中兩個距離最近的鈉離子中心間距離為面對角線的一半。晶胞中含有離子的個數均是4個,則晶胞邊長是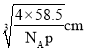 ,則晶體中兩個距離最近的鈉離子中心間距離為
,則晶體中兩個距離最近的鈉離子中心間距離為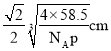 ,故答案為:
,故答案為: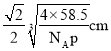 。
。


科目:高中化學 來源: 題型:
【題目】以黃銅礦(主要成分為 CuFeS2,含少量雜質SiO2等)為原料,進行生物煉銅,同時得到副產品綠礬(FeSO4·7H2O)。其主要工藝流程如下:
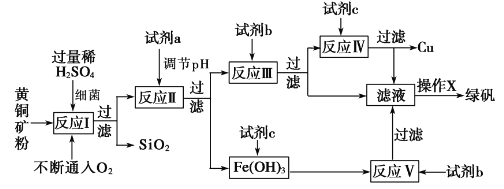
已知:部分陽離子以氫氧化物形式開始沉淀和完全沉淀時溶液的pH如下表。
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
開始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
下列說法不正確的是
A. 試劑a可以是CuO或Cu(OH)2,作用是調節pH至3.7~4.7之間
B. 反應I的化學反應方程式為4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,該反應中鐵元素被還原
C. 操作X為蒸發濃縮至溶液表面出現晶膜,再冷卻結晶
D. 反應Ⅲ的離子方程式為Cu2++Fe==Cu+Fe2+,試劑c參與反應的離子方程式分別為Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合物G可用于生產全生物降解塑料,在“白色污染”日益嚴重的今天有著重要的作用。有關轉化關系如下:
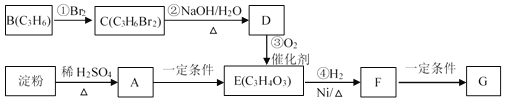
已知:CH3CH2CH2Br + NaOH![]() CH3CH2CH2OH + NaBr
CH3CH2CH2OH + NaBr
請回答下列問題:
(1)物質A的分子式為_______,B的結構簡式為_______;
(2)請寫出F中含氧官能團的名稱_______;
(3)反應①~④中屬于加成反應的是_______;
(4)寫出由F生成聚合物G的化學方程式_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為某植物葉綠體結構和功能的示意圖。請分析回答問題:
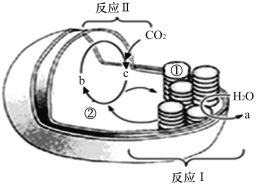
(1)物質a是____________,物質b是________________。
(2)光合作用的光反應階段發生在_______(填“Ⅰ”或“Ⅱ”),該反應將光能轉變為__________________。
(3)葉綠體增加膜面積的方式是____________________________________。在適宜光照和溫度條件下培養,由①處轉移至②處的物質主要是_____________________。
(4)該植物進行光合作用時,突然停止光照,C3的含量__________(填“升高”或“降低”或“不變”)。若用H![]() O培養該植物,發現葉肉細胞中出現了(CH
O培養該植物,發現葉肉細胞中出現了(CH![]() O),分析其最可能的轉化途徑是:_______________________(用相關物質、過程和箭頭表示)。
O),分析其最可能的轉化途徑是:_______________________(用相關物質、過程和箭頭表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的轉化在給定條件下能實現的是( )
①Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
②SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
③AlCl3![]() Al
Al![]() NaAlO2
NaAlO2
④Na![]() Na2O
Na2O![]() NaOH
NaOH
⑤SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
⑥飽和NaCl(ag)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
A. ①②⑤B. ②③⑥C. ②⑤⑥D. ①③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人體血液內的血紅蛋白(Hb)易與O2結合生成HbO2,因此具有輸氧能力,CO吸入肺中發生反應:CO+HbO2![]() O2+HbCO,37 ℃時,該反應的平衡常數K=220。HbCO的濃度達到HbO2濃度的0.02倍,會使人智力受損。據此,下列結論錯誤的是( )
O2+HbCO,37 ℃時,該反應的平衡常數K=220。HbCO的濃度達到HbO2濃度的0.02倍,會使人智力受損。據此,下列結論錯誤的是( )
A. 當吸入的CO與O2濃度之比大于或等于0.02時,人的智力才會受損
B. 人體吸入的CO越多,與血紅蛋白結合的O2越少
C. CO與HbO2反應的平衡常數K=![]()
D. 把CO中毒的病人放入高壓氧倉中解毒,其原理是使上述平衡向左移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1) CH2=CHCH=CH2的系統命名為______________;
(2)3—甲基—2一戊烯的結構簡式為______________;
(3)![]() 的分子式為______________;
的分子式為______________;
(4)某烴的分子式為C4H4,它是合成橡膠的中間體,它有多種同分異構體
①試寫出它的一種鏈式結構的同分異構體的結構簡式______________.
②它有一種同分異構體,每個碳原子均達飽和,且碳與碳的夾角相同,該分子中碳原子形成的空間構型為______________形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝酸工業尾氣中的氮氧化合物NOx(NO、NO2、N2O4)常用的處理方法有以下兩種:
①堿液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反應原理如下:
NO + NO2 + Na2CO3 == 2NaNO2 + CO2;2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反應原理是:NOx + NH3![]() N2 + H2O
N2 + H2O
現將標準狀況下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反應完全,且測得反應后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列說法正確的是
A. 混合氣體中V(N2O4) = 0.336 L
B. 混合氣體中n(NO)∶n(NO2) = 1∶5
C. NOx能夠完全被Na2CO3溶液吸收,則x ≤ 1.5
D. 如采用氨的催化氧化法處理,理論消耗n(NH3) = ![]() mol
mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一塊金屬鈉投入到滴有紫色石蕊試液的盛冷水的燒杯中,甲同學認為可觀察到下列現象,其中正確的有( )
①鈉投入水中,先沉入水底,后浮出水面
②鈉立即與水反應,并有氣體產生
③反應后溶液變紅
④鈉熔成閃亮的小球
⑤小球在水面上四處游動
⑥有“嘶嘶”的響聲發出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com