
【題目】已知還原性:Fe2+>Br-。向100mLFeBr2溶液中通入3.36L(標準狀況)Cl2,反應后的溶液中Cl-和Br-的物質的量濃度相等,則原溶液中FeBr2的物質的量濃度為( )
A. 2 mol·L-1 B. 1.5 mol·L-1 C. 1 mol·L-1 D. 0.75 mol·L-1
【答案】A
【解析】
因為還原性Fe2+![]() Br-,所以Cl2先與Fe2+反應,后與Br-反應,反應后溶液中Cl-和Br-的物質的量濃度相等,則Cl2完全反應,Fe2+完全反應、Br-部分反應;根據得失電子守恒和原子守恒列式。
Br-,所以Cl2先與Fe2+反應,后與Br-反應,反應后溶液中Cl-和Br-的物質的量濃度相等,則Cl2完全反應,Fe2+完全反應、Br-部分反應;根據得失電子守恒和原子守恒列式。
n(Cl2)=![]() =0.15mol,因為還原性Fe2+
=0.15mol,因為還原性Fe2+![]() Br-,所以Cl2先與Fe2+反應,后與Br-反應,反應后溶液中Cl-和Br-的物質的量濃度相等,則Cl2完全反應,Fe2+完全反應、Br-部分反應,根據Cl守恒,反應后溶液中n(Cl-)=0.15mol
Br-,所以Cl2先與Fe2+反應,后與Br-反應,反應后溶液中Cl-和Br-的物質的量濃度相等,則Cl2完全反應,Fe2+完全反應、Br-部分反應,根據Cl守恒,反應后溶液中n(Cl-)=0.15mol![]() 2=0.3mol;設原溶液中FeBr2物質的量為x,則原溶液中n(Fe2+)=x、n(Br-)=2x,根據得失電子守恒,0.15mol
2=0.3mol;設原溶液中FeBr2物質的量為x,則原溶液中n(Fe2+)=x、n(Br-)=2x,根據得失電子守恒,0.15mol![]() 2=x+(2x-0.3mol),解得x=0.2mol,原FeBr2溶液物質的量濃度為
2=x+(2x-0.3mol),解得x=0.2mol,原FeBr2溶液物質的量濃度為![]() =2mol/L,答案選A。
=2mol/L,答案選A。


科目:高中化學 來源: 題型:
【題目】甲醇是新型的汽車動力燃料。工業上可通過H2和CO化合制備甲醇,該反應的熱化學方程式為:2H2(g)+CO(g) ![]() CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知:CO和H2的燃燒熱分別為283kJ/mol、286kJ/mol 。1mol甲醇氣體完全燃燒生成CO2和液態水的熱化學方程式為_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g)![]() CH3OH(g)反應速率及原料平衡轉化率的是_____(填標號)。
CH3OH(g)反應速率及原料平衡轉化率的是_____(填標號)。
A.分離出CH3OH B.升高溫度 C.增大壓強 D.加入合適的催化劑
(3)在容積為2L的恒容容器中,分別在230℃、250℃、270℃下,改變H2和CO的起始組成比[(n(H2)/n(CO)],起始時CO的物質的量固定為1mol,實驗結果如圖所示:
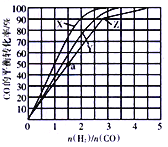
①Z曲線對應的溫度是__________,判斷的依據是________________。
②從圖中可以得出的結論是(寫兩條)____________________、______________________。
(4)利用圖中a點對應的數據,計算曲線Z對應溫度下反應2H2(g)+CO(g)![]() CH3OH(g)的平衡常數為____________;若在a點向容器中再充入1.5molCH3OH和0.5molH2,則原平衡___移動(填“向正反應方向”或“向逆反應方向”或“不”)
CH3OH(g)的平衡常數為____________;若在a點向容器中再充入1.5molCH3OH和0.5molH2,則原平衡___移動(填“向正反應方向”或“向逆反應方向”或“不”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以甲烷為原料合成甲醇的反應如下:
反應I:CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol
反應II:CO(g) + 2H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
已知: T1℃時,反應II 的平衡常數數值為100;T2℃時,反應II 在密閉容器中達到平衡,測得CO、H2、CH3OH的物質的量濃度(mol/L)分別為0.05、0.1、0.1。下列說法中,正確的是
A. 反應I中,使用催化劑可以減小△H1,提高反應速率
B. 反應II 中,加熱或加壓均可提高原料氣的平衡轉化率
C. 由上述數據可判斷反應II 的溫度: T1> T2
D. CO(g)+CH3OH(g)![]() CH4(g) +CO2(g) △H= +157 kJ/mol
CH4(g) +CO2(g) △H= +157 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,下列敘述不是可逆反應A(g)+3B(g)2C(g)達到平衡標志的是( )
①C的生成速率與C的分解速率相等;
②單位時間生成amol A,同時生成3amolB;
③A、B、C的濃度不再變化;
④A、B、C的物質的量不再變化
A.②B.④C.③D.①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,將4molPCl3和2molCl2充入容積不變的密閉容器中,在一定條件下反應:PCl3+Cl2PCl5 , 各物質均為氣態.達平衡后,PCl5為0.8mol.若此時再移走2molPCl3和1molCl2 , 相同溫度下達到平衡,PCl5的物質的量為( )
A.0.8mol
B.0.4mol
C.0.4mol<x<0.8mol
D.<0.4mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學仿照“噴泉”實驗的原理,在實驗室中做了一個“噴煙”實驗,如圖所示。
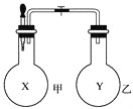
該同學在甲、乙兩個燒瓶中分別充入X、Y兩種無色氣體,在膠頭滴管中盛有含酚酞的氫氧化鈉溶液,實驗時將膠頭滴管內的液體擠入甲燒瓶內,然后打開止水夾,便可看到甲燒瓶中的導管口噴出白色的煙,同時甲燒瓶中的溶液顏色逐漸變淺。若已知X、Y是氯化氫、氨氣、氯氣、氧氣、甲烷、二氧化硫、一氧化氮七種氣體中的兩種,則下列判斷中,正確的是( )
A. X是氨氣,Y是氯化氫 B. X是氯氣,Y是甲烷
C. X是二氧化硫,Y是氧氣 D. X是一氧化氮,Y是氧氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對可逆反應aA(g)+bB(g)cC(g)+dD(g)達到平衡時,各物質的物質的量濃度滿足以下關系: ![]() =K(為一常數),K稱為化學平衡常數,其反應的K值只與溫度有關.現有反應:CO(g)+H2O (g)CO2(g)+H2(g)△H<0.在850℃時,K=1.
=K(為一常數),K稱為化學平衡常數,其反應的K值只與溫度有關.現有反應:CO(g)+H2O (g)CO2(g)+H2(g)△H<0.在850℃時,K=1.
(1)若升高溫度到950℃時,達到平衡時K1(填“大于”“小于”或“等于”)
(2)850℃時,若向一容積可變的密閉容器中同時充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2 , 則:
①當x=5.0時,上述平衡向(填“正反應”或“逆反應”)方向移動.
②若要使上述反應開始時向正反應方向進行,則x應滿足的條件是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.堿性:LiOH>NaOH>KOH>RbOHB.金屬性:Li>Na>K>Rb
C.原子半徑:Li>Na>K>RbD.熔沸點:Li>Na>K>Rb
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏伽德羅常數的值,下列敘述正確的是( )
A.常溫常壓下,22.4LCO2含有的分子數為1NA
B.常溫常壓下,1.06gNa2CO3含有的Na+離子數為0.02NA
C.通常狀況下,NA個CO2分子占有的體積約為22.4L
D.物質的量濃度為0.5mol/L的MgCl2溶液中,含有Cl﹣個數為1NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com