
【題目】某課外興趣小組需要用18mol/L 的濃硫酸配制80mL3.0mol/L 稀硫酸的實驗步驟如下:①計算所用濃硫酸的體積 ②量取一定體積的濃硫酸 ③稀釋 ④檢漏、轉移、洗滌 ⑤定容、搖勻。回答下列問題:
(1)所需濃硫酸的體積是___mL,量取濃硫酸所用的量筒的規格是___(用下列編號填空)。
A.10 mL B.25mL C.50mL D.100mL
(2)第⑤步實驗的操作是繼續向容量瓶中注入蒸餾水至離刻度線1-2cm處,改用___向容量瓶中滴加蒸餾水至凹液面和刻度線相切為止。塞緊瓶塞,倒轉搖勻并裝試劑瓶。
(3)下列情況對所配制的稀硫酸濃度有何影響?(填“偏大”“偏小”或“無影響”)
①容量瓶用蒸餾水洗滌后殘留有少量的水___;
②在轉入容量瓶前燒杯中溶液未冷卻至室溫___;
③取完濃硫酸后洗滌量筒,并把洗滌液倒入燒杯___。
【答案】16.7 B 膠頭滴管 無影響 偏大 偏大
【解析】
(1)配制80mL 3.0 mol/L稀硫酸,需要選用100 mL的容量瓶;根據稀釋規律c2V1=c2V2計算出濃硫酸的體積;據濃硫酸的體積選擇量筒的規格;
(2)根據定容操作方法進行分析;
(3)根據c=![]() 進行分析;
進行分析;
(1)配制80mL 3.0 mol/L稀硫酸,需要選用100 mL的容量瓶,因此需要18 mol/L濃硫酸的體積為![]() ,量筒的選擇方法為“近而大”,選擇25 mL量筒;
,量筒的選擇方法為“近而大”,選擇25 mL量筒;
(2)定容操作為:繼續向容量瓶注入蒸餾水至離刻度線1~2 cm處,改用膠頭滴管向容量瓶滴加至凹液面與刻度線相切;
(3)①容量瓶用蒸餾水洗滌后殘留有少量的水,因為定容時還需要加入蒸餾水,所以不影響配制結果;
②在轉入容量瓶前燒杯中溶液未冷卻至室溫,根據熱脹冷縮的原理,體積減小,濃度偏大;
③取完濃硫酸后洗滌量筒,并把洗滌液倒入燒杯,導致量取濃硫酸的體積增大,最終結果偏大。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列“實驗結論”與“實驗操作及現象”相符的一組是
選項 | 實驗操作及現象 | 實驗結論 |
A | 向某溶液中加入 | 該溶液中一定含有 |
B | 向某溶液中加入稀鹽酸,有無色氣體產生 | 該溶液中一定含有 |
C | 向某溶液中加入 | 該溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液變為紅色 | 該溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,某化學小組探究硝酸銀溶液的性質。
裝置 | 實驗序號 | 實驗操作 | 實驗現象 |
| 實驗I | 向試管中滴加2%氨水并不斷振蕩 | 產生棕褐色沉淀,繼續滴加沉淀消失 |
實驗II | 1.向試管中加入0.1mol·L-lNaOH溶液1mL 2.繼續滴加3%H2O2至過量 | 1.產生棕褐色沉淀 2.產生大量無色無味氣體,有黑色沉淀生成 | |
實驗III | 1.向試管中滴加1mL0.1molL-1KI溶液 2.取少量上層清液于試管甲中,加入淀粉溶液 | 1.產生黃色沉淀 2.溶液無明顯變化 |
已知:AgOH是一種白色固體,常溫下極不穩定,易分解為棕褐色難溶于水的氧化銀固體
(1)常溫下,0.1mo1L-1AgNO3溶液pH約為4,請用離子方程式解釋原因___。
(2)實驗I中,反應的化學方程式是___。
(3)實驗II中,經檢驗,黑色沉淀的成分為Ag。有Ag產生的化學方程式是___。經測定,實驗產生的氣體體積遠遠大于該反應的理論值,可能的原因是___。
(4)實驗中,產生黃色沉淀的離子方程式是___。有同學猜想,I-有還原性,Ag+有氧化性,AgNO3溶液與KI溶液應該可以發生氧化還原反應。他設計了如圖原電池,做實驗IV證明了猜想成立。其中,在A燒杯中,石墨電極表面變亮,經檢測這種光亮的物質為銀單質。乙溶液是___,檢驗B燒杯中產物的操作及現象是___,該氧化還原反應的離子方程式是__。

(5)對比實驗III和實驗IV,實驗III無I2生成的可能原因是___(寫出兩條)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2S催化分解過程中通入CO2、CH4會發生如下反應,下列說法不正確的是
A.CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)壓縮容器體積,平衡轉化率將增大
2H2(g)+2CO(g)壓縮容器體積,平衡轉化率將增大
B.H2S(g)+CO2(g)![]() H2O(g)+COS(g)通入CO2,將促進反應的進行
H2O(g)+COS(g)通入CO2,將促進反應的進行
C.已知2H2S(g)+CH4(g)![]() 4H2(g)+CS2(g) △H>0,則該反應在高溫下易自發
4H2(g)+CS2(g) △H>0,則該反應在高溫下易自發
D.2H2S(g)![]() 2H2(g)+S(g) △H>0
2H2(g)+S(g) △H>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組數據中,前者剛好是后者兩倍的是 ( )
A. 2 mol H2O的摩爾質量和1 mol H2O的摩爾質量
B. 200 mL 1 mol·L-1氯化鈣溶液中c(Cl-)和100 mL 2 mol·L-1氯化鉀溶液中c(Cl-)
C. 64 g二氧化硫中氧原子數和標準狀況下22.4 L一氧化碳中氧原子數
D. 20% NaOH溶液中NaOH的物質的量濃度和10% NaOH溶液中NaOH的物質的量濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一固體混合物,可能由K2CO3、NaNO2、FeCl3、KClO3、AgNO3混合而成,為檢驗它的成分,做了如下實驗:取固體加入足量的稀硝酸中,攪拌充分反應,得到無色透明溶液,同時有黃綠色氣體和白色沉淀生成![]() 已知NaNO2不能被稀硝酸氧化)。根據以上實驗現象,你認為以下判斷正確的是
已知NaNO2不能被稀硝酸氧化)。根據以上實驗現象,你認為以下判斷正確的是
A.一定含有KClO3、AgNO3、NaNO2,不能肯定是否含有氯化鐵
B.一定含有KClO3,且在反應過程中被還原生成了兩種還原產物
C.另取適量固體加水溶解,若出現白色沉淀,即可證明K2CO3的存在
D.將反應產生的氣體通入少量澄清石灰水,若有無沉淀出現,即可證明K2CO3不存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某化合物A由兩種元素組成,可以發生如下的轉化。
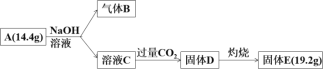
已知:標準狀況下,氣體B的密度是氫氣的8倍。請回答:
(1)組成A的元素有_________,A的化學式是_________
(2)請寫出A與NaOH溶液反應的化學方程式_________
(3)A可用于金屬的冶煉,請寫出A與Fe2O3的化學反應方程式_________
Ⅱ.某實驗小組做了如下實驗:

請回答:
(1)寫出硬質管中發生反應的化學方程式:_________
(2)有同學認為乙醇的催化氧化反應產物中含有乙酸,請設計實驗檢驗產物成分:_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤、水煤氣、甲醇、乙醇等都是重要的化工原料。
(1)水煤氣生產原理是:C(s)+H2O(g) ![]() CO(g)+ H2(g) ΔH = +131.3kJ·mol-1。
CO(g)+ H2(g) ΔH = +131.3kJ·mol-1。
①能說明該反應達到平衡狀態的是______(填字母)。
A.v正(CO)= v正(H2) B.c(CO)=c(H2)
C.恒容容器中,氣體密度不變 D.恒容容器中,氣體壓強不變
②該反應達到化學平衡時,若要增大水蒸氣的轉化率可采取的措施是____(填字母)。
A.增加碳的物質的量 B.增加水蒸氣的物質的量
C.增大壓強 D.升高溫度
(2)已知:CO(g)+ 2H2 (g)![]() CH3OH(g)。等物質的量的 CO與H2在催化劑作用下反應生成甲醇,平衡后若將容器的容積壓縮為原來的一半(其他條件不變),對平衡體系產生的影響是______(填字母)。
CH3OH(g)。等物質的量的 CO與H2在催化劑作用下反應生成甲醇,平衡后若將容器的容積壓縮為原來的一半(其他條件不變),對平衡體系產生的影響是______(填字母)。
A.c( H2 )減少 B.CH3OH 的物質的量增加 C.重新平衡時![]() 減小
減小
(3)已知6H2(g)+2CO2(g) ![]() CH3CH2OH(g)+3H2O(g) 。在溫度為T℃,容積不變的密閉容器中,將3mol H2和1mol CO2混合,達到平衡時CO2氣體的體積分數為a。
CH3CH2OH(g)+3H2O(g) 。在溫度為T℃,容積不變的密閉容器中,將3mol H2和1mol CO2混合,達到平衡時CO2氣體的體積分數為a。
①達到平衡時,轉化率α(H2):α(CO2) = ______。
②恒容下,再向該容器中充入2mol He,則H2的轉化率______(填“增大” 、“減小” 或“不變”)。
③在T℃,容積可變的密閉容器中將3mol H2和1mol CO2混合,達到平衡時CO2氣體的體積分數_______a(填“>” 、“<” 或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗小組需要1 molL﹣1的CuSO4 溶液80 mL,現用膽礬(CuSO4·5H2O)來配制,請回答下列問題:
(1)需稱取膽礬 ______g。
(2)配制過程中,不需要的儀器(填序號)________。
A.藥匙 B.酒精燈 C.托盤天平 D.燒杯 E.玻璃棒 F.蒸發皿
完成配制實驗還缺少的儀器是________。
(3)在配制過程中,下列操作能引起所配溶液濃度偏低的有_____(填序號)。
①轉移前,容量瓶中含有少量蒸餾水 ②轉移時有少量液體濺出
③定容時,俯視刻度線 ④顛倒搖勻后發現液面低于刻度線,再加水至刻度線
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com