
【題目】將0.2mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等體積混合后,取混合液分別完成下列實驗,能說明溶液中存在化學平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
實驗編號 | 實驗操作 | 實驗現象 |
① | 滴入KSCN溶液 | 溶液變紅色 |
② | 滴入AgNO3溶液 | 有黃色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有藍色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液變藍色 |
已知:離子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(藍色沉淀).
A. ①和② B. ②和④ C. ③和④ D. ①
【答案】D
【解析】將0.2mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等體積混合后,根據方程式可知碘離子過量,因此只需要證明溶液中含Fe3+即能證明此反應為可逆反應,能建立化學平衡。①向溶液中滴入KSCN溶液,溶液變紅,則說明溶液中有Fe3+,即能說明反應存在平衡,①正確;②由于碘離子過量,所以向溶液中滴入AgNO3溶液一定有黃色沉淀生成,不能說明反應存在平衡,②錯誤;③無論反應存不存在平衡,溶液中均存在Fe2+,滴入K3[Fe(CN)6]溶液均有藍色沉淀生成,③錯誤;④無論反應存不存在平衡,溶液中均有I2,滴入淀粉溶液后溶液均變藍色,故不能證明存在平衡,④錯誤;答案選D。


 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
【題目】T ℃時,在0.5 L的密閉容器中,氣體A與氣體B反應生成氣體C,反應過程中A、B、C的濃度變化如圖所示。則下列結論正確的是

A. 10 s時反應生成了0.2 mol C
B. 該反應進行到10 s時,消耗了0.2 molA
C. 該反應的化學方程式為3A+B![]() 2C
2C
D. 10 s內用B表示的反應速率為0.01 mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列電解質溶液有關敘述正確的是
A.恒溫條件下稀釋氫氟酸時,HF的Ka增大,水的KW不變
B.向Mg(OH)2沉淀懸濁液中加入NH4Cl固體,c(Mg2+)、c(OH-)濃度均增大
C.0.1mol/LNaHCO3溶液中,c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.0.1mol/LNa2SO3溶液中,加入少量NaOH固體,c(![]() )與c(Na+)均增大
)與c(Na+)均增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物F是用于制備藥品鹽酸祛炎痛的中間產物,已知其合成路線如下:
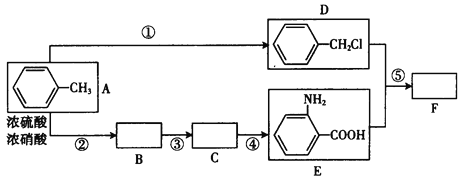
Ⅰ.RNH2+![]() CH2Cl
CH2Cl![]() RNHCH2
RNHCH2![]() +HCl(R和
+HCl(R和![]() 代表烴基)
代表烴基)
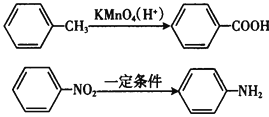
Ⅱ.苯的同系物易被高錳酸鉀溶液氧化如下:
Ⅲ.苯胺具有弱堿性,易氧化。
回答下列問題:
(1)寫出反應①的反應物質和條件_____________,B中所含官能團的名稱_____________,C的結構簡式__________________。
(2)D+E→F的化學方程式:______________。
(3)E的一種同分異構體(對位氨基)在一定條件下,可聚合成熱固性很好的功能高分子,寫出合成此高聚物的化學方程式__________________。
(4)寫出D的含有苯環的同分異構體,已知該核磁共振氫譜圖有3種不同類型的氫原子,峰面積之比為3 :2 :2,則該物質是______________(寫結構簡式)。
(5)反應①~⑤中,屬于取代反應的是(填反應序號)________________,反應③的反應類型_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲苯(![]() )是一種重要的化工原料,能用于生產苯甲醛(
)是一種重要的化工原料,能用于生產苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等產品。下表列出了有關物質的部分物理性質,請回答:
)等產品。下表列出了有關物質的部分物理性質,請回答:
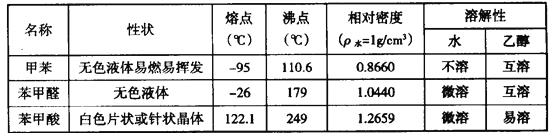
注:甲苯、苯甲醛、苯甲酸三者互溶; 酸性: 苯甲酸>醋酸
實驗室可用如圖裝置模擬制備苯甲醛。實驗時先在三頸瓶中加入0.5g固態難溶性催化劑,再加入15mL冰醋酸和2mL甲苯,攪拌升溫至70℃,同時緩慢加入12mL過氧化氫,在此溫度下攪拌反應3小時。
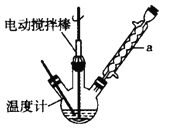
(1)裝置a的名稱是____ ____,主要作用是 。三頸瓶中發生反應的化學方程式為 ,此反應的原子利用率理論上可達 。
(2)經測定,反應溫度升高時,甲苯的轉化率逐漸增大,但溫度過高時,苯甲醛的產量卻有所減少,可能的原因是________________。
(3)反應完畢后,反應混合液經過自然冷卻至室溫時,還應經過________、________(填操作名稱)等操作,才能得到苯甲醛粗產品。
(4)實驗中加入過量的過氧化氫并延長反應時間時,會使苯甲醛產品中產生較多的苯甲酸。
①若想從混有苯甲酸的苯甲醛中分離出苯甲酸,正確的操作步驟是_______(按步驟順序填字母)。
a.對混合液進行分液 b.過濾、洗滌、干燥
c.水層中加入鹽酸調節pH=2 d.與適量碳酸氫鈉溶液混合震蕩
②若對實驗①中獲得的苯甲酸產品進行純度測定,可稱取1.200g產品,溶于100mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于錐形瓶,滴加2~3滴酚酞指示劑,然后用預先配好的0.1000mol/L KOH標準液滴定,到達滴定終點時消耗KOH溶液18.00mL。產品中苯甲酸的質量分數為________。
③下列情況會使測定結果偏低的是__________(填字母)。
a.滴定終點時俯視讀取耗堿量 b.KOH標準液長時間接觸空氣
c.配制KOH標準液時仰視定容 d.將酚酞指示劑換為甲基橙溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是( )
A.纖維素可以水解生成葡萄糖,因此纖維素屬于基本營養物質
B.戊烷(C5H12)有兩種同分異構體
C.苯、溴苯、乙醇可以用水鑒別
D.乙醇可以直接氧化成乙酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室采用MgCl2、AlCl3的混合溶液與過量氨水反應制備MgAl2O4的主要流程如下:
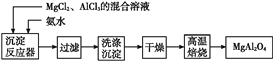
(1)制備MgAl2O4過程中,高溫焙燒時發生反應的化學方程式為_____________。
(2)判斷流程中沉淀是否洗凈所用的試劑是__________________。
(3)在25 ℃下,向濃度均為0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成______沉淀(填化學式),生成該沉淀的離子方程式:_____________。{已知25 ℃時Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34}。
(4)無水AlCl3(183 ℃升華)遇潮濕空氣即產生大量白霧,實驗室可用下列裝置制備。
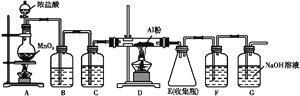
裝置B中盛放飽和NaCl溶液,該裝置的主要作用是______;F中試劑的作用是__________________________________________。
(5)將Mg、Cu組成的3.92 g混合物投入過量稀硝酸中,充分反應后,固體完全溶解時收集到還原產物NO氣體1.792 L(標準狀況),向反應后的溶液中加入4 mol·L-1的NaOH溶液80 mL時金屬離子恰好完全沉淀。則形成沉淀的質量為____g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關Na2CO3和NaHCO3的說法不正確的是( )
A.等質量的Na2CO3和NaHCO3分別與足量鹽酸反應,NaHCO3產生的CO2多
B.等物質的量的鹽酸分別與足量的Na2CO3和NaHCO3反應,Na2CO3產生的CO2多
C.相同溫度在水中的溶解度:Na2CO3大于NaHCO3
D.等物質的量的Na2CO3和NaHCO3分別與足量的鹽酸反應,消耗鹽酸的量一樣多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將幾滴KSCN(SCN-是“類似鹵離子”)溶液加入到酸性的含有Fe3+的溶液中,溶液變為紅色,將該紅色溶液分為兩份:①向其中—份溶液中加入適量KMnO4溶液,紅色褪去;②向另一份溶液中通入SO2,紅色也褪去。下列說法中不正確的是
A. ①中紅色褪去的原因是KMnO4將SCN-氧化,使Fe(SCN)3消失
B. ②中紅色褪色的原因是SO2將Fe3+還原為Fe2+
C. ②中紅色裡色的原因是SO2將SCN-還原
D. SCN-在適當條件下可失去電子被氧化劑氧化為(SCN)2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com