
【題目】用1000g溶劑中所含溶質的物質的量來表示的溶液濃度叫質量物質的量濃度,其單位是mol/kg。5mol/kg的硫酸的密度是1.29g/cm3,則其物質的量濃度是( )
A. 3.56mol/LB. 4.33mol/LC. 5.00mol/LD. 5.23mol/L
 新課標快樂提優暑假作業陜西旅游出版社系列答案
新課標快樂提優暑假作業陜西旅游出版社系列答案 暑假銜接培優教材浙江工商大學出版社系列答案
暑假銜接培優教材浙江工商大學出版社系列答案科目:高中化學 來源: 題型:
【題目】在一定溫度下,反應HX(g)![]() 1/2H2(g)+ 1/2X2(g) 的平衡常數為0.1。若將等物質的量的H2(g)和X2(g)通入體積為1L的密閉容器中,在該溫度下HX(g)的最大產率接近于( )
1/2H2(g)+ 1/2X2(g) 的平衡常數為0.1。若將等物質的量的H2(g)和X2(g)通入體積為1L的密閉容器中,在該溫度下HX(g)的最大產率接近于( )
A. 83% B. 17% C. 5% D. 33%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、Q為原子序數依次增大的前四周期元素,X核外未成對電子數有2個,與其他元素均能形成二元化合物;Y是地殼中含量最多的金屬元素;Z是遺傳物質的組成元素之一;W內層電子數是最外層電子數的9倍;Q基態原子價層電子排布中成對電子數和未成對電子數相同,且成對電子數為最外層電子數的2倍。據此回答下列問題:
(1)Q的基態原子的價層電子排布式為___________________________。
(2)X、Y、Z、W四種元素中,電負性最大的是_________(填元素符號,下同);同周期元素中,第一電高能介于Y和Z之間的有__________________。
(3)Y和W的氯化物熔點高的是______(填化學式),原因是_____________________;與Z的低價氯化物互為等電子體的離子是_______(填離子符號)。
(4)咖啡因對中樞神經有興奮作用,其結構簡式如圖所示。常溫下,咖啡因在水中的溶解度為2g,加適量水楊酸鈉[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的雜化類型有___________________。

(5)已知WX的密度為3.25g/cm3,單元晶胞邊長481pm,經計算可確定該單元晶胞中含有____個WX,說明在形成晶體時,半徑大的粒子先進行了_______方式的堆積,晶胞中距離W最近的X有_____個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F均為短周期主族元素,且原子序數依次遞增。A的原子核內無中子,B的原子最外層電子數是次外層電于數的2倍,C是地殼中含量最多的元素,D是短周期中金屬性最強的元素,E與F位置相鄰,F是同周期元素中原子半徑最小的元素。
完成下列填空題:
(1)B在元素期表中的位置為_______,1個C原子核外有____個未成對的電子。
(2)D、E、F三種元素形成簡單離子其半徑由l大到小的順序是_____________。(用離子符號表示)。
(3)寫出D與C形成化合物的電子式______、_______。
(4)常溫下,1molA的單質在C的單質中完全燃燒生成液態化合物,并放出286kJ的熱量,該反應的熱化學方程式為______________。
(5)非金屬性的強弱:E_____F(填“強于”、“弱于”、“無法比較”),試從原子結構的角度解釋其原因________________。
(6)Na2SO3可用作漂白織物時的去鼠劑。Na2SO3溶液及收Cl2后,溶液的酸性增強。寫出該反應的離子方程式______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知鈉、氯及其化合物間有如下轉化關系,
請按要求填空:
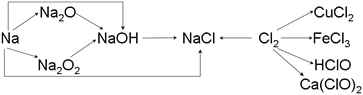
(1)實驗室中金屬鈉通常保存在_______中,一小塊金屬鈉投入水中反應的化學方程式是________________。
(2)Na2O2常用于呼吸面具中,有關反應的化學方程式為_____________________________,_________________________________。
(3)新制的氯水滴入紫色石蕊試液中,觀察到的現象是___________________________。
請寫出氯氣與水反應的化學方程式_______________________________。
(4)工業上用氯氣和石灰乳反應制漂白粉,其化學方程式為_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出木炭與濃硫酸反應的化學方程式____。
為了驗證產物中的二氧化碳氣體,甲、乙兩同學分別設計如下實驗(已知Br2+2H2O+SO2=H2SO4+2HBr):
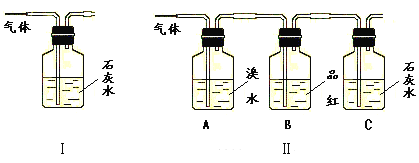
請回答下列問題:
(1)能否根據Ⅰ裝置中石灰水變渾濁的現象說明產物中一定有二氧化碳氣體?___,理由是____。
(2)Ⅱ裝置中A的作用是___;B的作用是___。
(3)根據B中品紅__,C中產生___,說明產物中一定有二氧化碳氣體。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室由間苯二酚合成2-硝基-1,3-苯二酚的原理如下:

已知:
物質 | 間苯二酚 | 2-硝基-1,3-苯二酚 |
熔點 | 109~112℃ | 84.85℃ |
沸點 | 276.5℃ | 234℃ |
溶解性 | 易溶于水 | 微溶于水 |
相對分子質量 | 110 | 155 |
實驗藥品:間苯二酚、濃硫酸(98%)、混合酸(由濃硝酸和濃硫酸按2:3的體積比混合而成)、尿素等。
實驗步驟:
Ⅰ.稱取2.7g間苯二酚粉末,放入100mL錐形瓶中,再加入13mL濃硫酸,同時充分攪拌,反應放熱,立即生成白色磺化物。
Ⅱ.當反應物冷卻后,用滴管滴加預先用冰水浴冷卻好的混合酸,同時進行攪拌,并使反應溫度不超過30℃.將生成的黃色粘稠狀液體在室溫下放置15min,再用7.5mL帶有碎冰的冷水稀釋,保持溫度在50℃以下,得到紅褐色的稠狀液體。
Ⅲ.將反應液轉移至250mL燒瓶中(如右下圖所示,夾持和加熱裝置均已略去),再加入0.1g尿素,進行蒸餾,蒸餾液通過抽濾,洗滌干燥后,可得到橘紅色片狀晶體粗品。

試回答下列問題:
(1)進行產物蒸餾時,冷卻水應從______(填“a”或“b”)口進入。
(2)實驗過程中,溫度控制在較低溫度下進行的原因可能是:______。
(3)實驗過程中配制混酸的正確操作是:______。
(4)加入尿素,其目的是使多余的硝酸和尿素反應而被除去。其中反應之一的化學方程式為:2CO(NH2)2+6HNO3=NH4NO3+8NO↑+2CO2↑+5H2O,若生成1.12LCO2(標準狀況下)時,則轉移的電子數為______。
(5)對粗品進行(方法)可提高產品純度。若干燥后稱量所得產品的質量為 2.1g,則其產率為______(保留兩位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在恒容密閉容器中,能表示反應X(s)+2Y(g)![]() 2Z(g)一定達到化學平衡狀態的
2Z(g)一定達到化學平衡狀態的
①容器中氣體的密度不再發生變化 ②Y的濃度不再發生變化
③容器中的壓強不再發生變化 ④單位時間內生成2mol Z,同時消耗2mol Y
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2NO2(紅棕色)![]() N2O4(無色) ΔH<0。將一定量的NO2充入注射器中并密封,改變活塞位置的過程中,氣體透光率隨時間的變化如圖所示(氣體顏色越深,透光率越小)。下列說法不正確的是( )
N2O4(無色) ΔH<0。將一定量的NO2充入注射器中并密封,改變活塞位置的過程中,氣體透光率隨時間的變化如圖所示(氣體顏色越深,透光率越小)。下列說法不正確的是( )

A. b點達到了平衡狀態
B. b點對應的時刻改變的條件是將注射器的活塞向外拉
C. d點:v(正)<v(逆)
D. 若在c點將溫度降低,其透光率將增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com