
【題目】某研究性學習小組請你參與“研究鐵與水反應利用”實驗,并檢驗產物的性質:
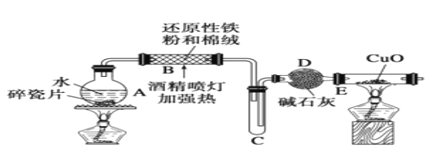
(1)B中與水蒸氣發生反應的化學方程式為_____________________.
(2)D中堿石灰的作用是_____________________.
(3)E中實驗現象是______________________.
(4)上述實驗結束后,取出B中鐵粉反應后的少量固體繼續進行如下實驗:
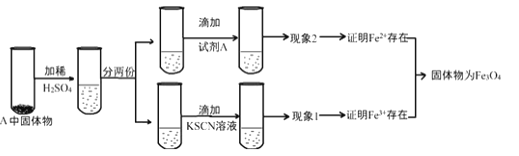
①B中產物與稀硫酸發生的離子方程式為:______________。
②試劑A是_________________(選填字母)。
NaOH溶液 b酸性KMnO4溶液 c.酚酞d.氯水
③若用電子天平稱取鐵粉質量為0.1527g,測得生成氫氣體積為73.50mL(實驗室條件下氣體摩爾體積為24.5L/mol).則參加反應的鐵粉占稱取鐵粉的百分數為_______(精確到0.1%)。
④有同學認為:即使得到了現象1和現象2的實驗現象,也不能確定所得固體成分為Fe3O4。你認為該同學持此看法的理由是____________。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 吸收水蒸氣,干燥氫氣 黑色固體變紅,右端管壁有水珠 Fe3O4+8H+=2Fe3++Fe2++4H2O b 82.5% 答案一:鐵粉也可以與稀硫酸反應生成二價鐵。答案二:產物是FeO和Fe2O3的混合物也能得到現象1和現象2
Fe3O4+4H2 吸收水蒸氣,干燥氫氣 黑色固體變紅,右端管壁有水珠 Fe3O4+8H+=2Fe3++Fe2++4H2O b 82.5% 答案一:鐵粉也可以與稀硫酸反應生成二價鐵。答案二:產物是FeO和Fe2O3的混合物也能得到現象1和現象2
【解析】
由圖可知,A中加熱提供水蒸氣,在B中發生Fe與水蒸氣的反應生成四氧化三鐵和氫氣,C為緩沖裝置,D中干燥管干燥氫氣,E為氫氣還原氧化銅的裝置,以此來解答。
(1)B中鐵與水蒸氣發生反應生成四氧化三鐵和氫氣,反應的化學方程式為3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)生成的氫氣中含有水蒸氣,與氧化銅反應之前需要除去,則D中堿石灰的作用是吸收水蒸氣,干燥氫氣;
(3)在加熱的條件下氫氣與氧化銅反應生成銅和水,則E中實驗現象是黑色固體變紅,右端管壁有水珠;
(4)①B中產物是四氧化三鐵,與稀硫酸發生的離子方程式為Fe3O4+8H+=2Fe3++Fe2++4H2O。
②由于溶液中含有鐵離子和亞鐵離子,要檢驗亞鐵離子,可以利用其有還原性、能使酸性高錳酸鉀溶液褪色來檢驗,則試劑A是酸性KMnO4溶液,答案選b;
③生成氫氣的物質的量是0.0735L÷24.5L/mol=0.003mol,根據方程式3Fe+4H2O(g)![]() Fe3O4+4H2可知消耗鐵是0.003mol×3/4=0.00225mol,質量是0.00225mol×56g/mol=0.126g,則參加反應的鐵粉占稱取鐵粉的百分數為0.126g/0.1527g×100%≈82.5%;
Fe3O4+4H2可知消耗鐵是0.003mol×3/4=0.00225mol,質量是0.00225mol×56g/mol=0.126g,則參加反應的鐵粉占稱取鐵粉的百分數為0.126g/0.1527g×100%≈82.5%;
④由于鐵粉也可以與稀硫酸反應生成二價鐵,另外如果產物是FeO和Fe2O3的混合物也能得到現象1和現象2,所以即使得到了現象1和現象2的實驗現象,也不能確定所得固體成分為Fe3O4。


科目:高中化學 來源: 題型:
【題目】為驗證鹵素單質氧化性的相對強弱,某小組用下圖所示裝置進行實驗(夾持儀器己略去,氣密性已檢驗)。
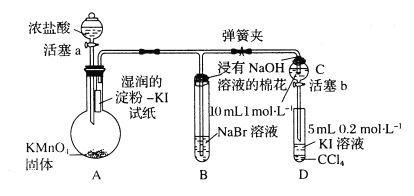
實驗過程:
I.打開彈簧夾,打開活塞a,滴加濃鹽酸。
II.當B和C中的溶液都變為黃色時,夾緊彈簧夾。
III.當B中溶液由黃色變為紅棕色時,關閉活塞a。
IV.……
(1)A中產生黃綠色氣體的化學反應方程式是___________。
(2)驗證氯氣的氧化性強于碘的實驗現象是___________。
(3)B中溶液發生反應的離子方程式是___________。
(4)為驗證溴的氧化性強于碘,過程Ⅳ的操作是___________,現象是___________。
(5)過程III實驗的目的是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知 25℃時有關弱酸的電離平衡常數:
弱酸化學式 | CH3COOH | HCN | H2CO3 |
電離平衡常數 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列有關說法正確的是
A. 1 mol·L-1HCN溶液與1mol·L-1 NaOH溶液等體積混合后,測得所得溶液顯酸性
B. 等物質的量濃度的各溶液pH關系為:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
C. NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-)
D. 1mol/L醋酸溶液加水稀釋,所有離子濃度均減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式的書寫中正確的是
A.氫氧化鐵與鹽酸反應:H++OH-=H2O
B.鐵與鹽酸反應:2Fe+6H+=2Fe3++3H2↑
C.氧化銅溶于稀硫酸:CuO+2H+=Cu2++H2O
D.向沸水中滴加FeCl3溶液制備Fe(OH)3膠體:Fe3++3H2O=Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某強酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干種,現取X溶液進行連續實驗,實驗過程及產物如下:下列說法不正確的是

A.氣體A是NO
B.X中不能確定的離子是 A13+和C1ˉ
C.溶液E和氣體F能發生化學反應
D.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1L氯化鐵和氯化鋁的混合液中,Fe3+的物質的量濃度為0.4mol/L,Cl-的物質的量濃度為1.8 mol/L。要使Fe3+全部轉化為沉淀分離出來,至少需要加入 4 mol/L NaOH溶液的體積為( )
A. 450mL B. 500mL C. 300mL D. 200mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化鎂在醫藥、建筑等行業應用廣泛。硫酸鎂還原熱解制備高純氧化鎂是一種新的探索。以菱鎂礦(主要成分為MgCO3,含少量FeCO3 )為原料制備高純氧化鎂的實驗流程如下:

(1)MgCO3 與稀硫酸反應的化學方程式為__________________________。
(2)加入H2O2 氧化時,發生反應的離子方程式為__________________________。
(3)濾渣2 的成分是____________(填化學式)。
(4)煅燒過程存在以下反應:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下圖裝置對煅燒產生的氣體進行分步吸收或收集。

①D中通過排水法收集的氣體可以是___________(填化學式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黃色固體與熱的NaOH溶液反應,產物中元素最高價態為+4,寫出該反應的離子方程式:______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗操作或說法中不正確的是( )
A.過濾后濾液仍然渾濁,無需再過濾了
B.實驗室制備蒸餾水的實驗中,棄去開始盛接在錐形瓶中的液體
C.萃取分液操作用到分液漏斗
D.蒸發食鹽水所用的蒸發皿不需要墊石棉網
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com